7月28日早间,恒瑞医药发布公告称,公司与GlaxoSmithKlineIntellectualProperty(No.3)Limited和GlaxoSmithKlineIntellectualProperty(No.4)Limited公司(统称“GSK”)达成协议,将用于治疗慢性阻塞性肺病的HRS-9821项目的全球独家权利(不包括中国)和至多11个项目的全球独家许可的独家选择权(不包括中国)有偿许可给GSK。
交易中的其他11个项目涉及肿瘤、呼吸、自免和炎症等多个治疗领域的创新药物,目前均处于非临床研究阶段。恒瑞医药将主导这些项目的研发,最晚至完成包括海外受试者数据的Ⅰ期临床试验。
根据协议条款,恒瑞医药将获得包括PDE3/4授权在内的5亿美元首付款。如果所有项目均获得行使选择权且所有里程碑均已实现,恒瑞医药将获得未来基于成功开发、注册和销售里程碑付款的潜在总金额约120亿美元。恒瑞医药将有权向GSK收取相应的分梯度的销售提成(不包括中国)。
当日,恒瑞医药A股午后拉升涨停,创2021年7月以来新高;H股涨幅达24.54%,报收84.75元/股,再创上市新高。
出海,正在成为国内创新药企破除内卷的新出路。方正证券数据显示,2024年我国创新药海外授权交易总金额同比增长26%,2025年上半年首付款已超25亿美元,交易总金额超500亿美元。
国内创新药企加速出海
今年以来,国内创新药继续加速出海加速。5月20日,三生制药与辉瑞就PD-1/VEGF双抗(SSGJ-707)达成授权协议,辉瑞将获得SSGJ-707在全球(不包括中国内地)的独家开发、生产及商业化权利,三生制药将获得12.5亿美元首付款及最多48亿美元的开发、监管批准及销售里程碑付款,并收取双位数百分比的梯度销售分成。此外,辉瑞将于协议生效日认购三生制药价值1亿美元的普通股股份。此次交易首付款再次刷新国产创新药出海纪录。
6月5日,智翔金泰(688443.SH)宣布,与纳斯达克上市公司CullinanTherapeutics,Inc.(NASDAQ:CGEM;下称“Cullinan”)达成海外授权合作协议。
根据协议,Cullinan将获得智翔金泰抗BCMA×CD3双特异性抗体——GR1803注射液(Velinotamig)在大中华区(包含中国大陆、中国香港、中国澳门、中国台湾)以外的全球开发、生产及商业化权益。智翔金泰将保留GR1803注射液在中国内地的开发、生产、商业化权益,并积极推进现有临床适应症的开发及在国内的上市。智翔金泰将获得Cullinan支付的2000万美元的首付款,最高达6.92亿美元的潜在里程碑付款,以及在大中华区外基于净销售额的分级特许权使用费。
6月26日,迈威生物公告,公司与CALICO拟就IL-11靶向治疗(包括9MW3811)签署《独家许可协议》,根据许可协议,迈威生物独家许可CALICO在除大中华区以外的所有区域内独家开发、生产和商业化许可产品的权利。迈威生物可获得首付款2500万美元及最高达5.71亿美元的里程碑付款,以及按许可产品净销售额计算的阶梯式特许权使用费。
……
国联民生证券认为,创新药或将逐步进入兑现期。2025年预计是国内创新药授权出海的重要年份,自2018年国家药品集采政策实施以后,国内企业纷纷开始从仿制药向创新药转型,至今7年时间,已陆续进入兑现期。部分先驱创新药企业有望实现盈亏平衡,利润端转正。
谨防“一劳永逸”之心
与国外企业达成授权合作,无疑是开了好头。但国内药企想全额拿到里程碑款,并不是件容易的事。
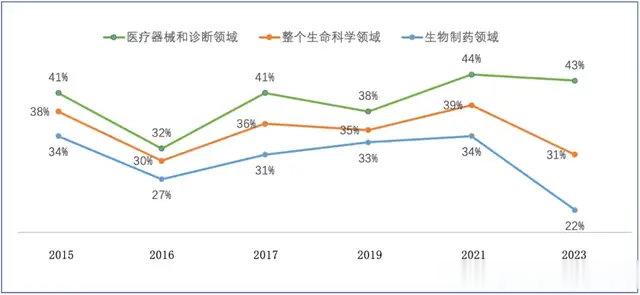
美国市场调研公司SRSACQUIOM在2023年9月发布的报告显示,过去9年生物制药领域的商业化(BD)交易中,60%以上的里程碑无法达成。2023年初至9月,生物制药领域里程碑整体兑现率仅22%。
图:2015~2023年里程碑事件达成率
据动脉网不完全统计,截至2025年4月20日,在2020年已完成的62起license-out交易中,目前有25起已明确终止合作,“退货率”为40%。而2021年和2022年的“退货率”当前也达到20%左右。
障碍到底在哪?
原因之一是买方会因后续疗效不佳而突然选择终止合作。比如石药集团Claudin18.2ADC项目与ElevationOncology的11.95亿美元交易,最终因美国I期数据客观缓解率仅22.2%,未达预期而终止。
更多扰动因素则在于买方这边。一方面,买方可能随时会因战略调整而终止合作。2024年1月,美国Coherus公司选择“退货”君实生物JS006,原因之一是2023年9月,Coherus收购了SurfaceOncology,在重新清点管线后,要将资源分配给管线中最有前途或最具竞争力的候选产品。Coherus表示,终止与君实生物在TIGIT项目上的合作符合利益最大化原则。
另一方面,买方所在地政府尤其是美国FDA有可能突然“变脸”。2019年,在美国癌症研究协会会议上,美国食药监局(FDA)肿瘤学卓越中心主任RichardPazdur鼓励中国制药公司为美国市场带来更多PD-1/PD-L1抑制剂,以此加大竞争,进而降低美国用药价格。但真当中国企业拿出一堆PD-1、PD-L1时,FDA又拒绝认账,开始吹毛求疵挑毛病。
此外,里程碑界定不明也会产生纠纷。2019年,日本医疗企业第一三共曾以1.5亿美元和最高9亿美元里程碑付款,获得Esperion两款复方制剂Nexletol等在欧洲等地区的独家商业化权益。2022年12月,Nexletol扩展适应症的Ⅲ期临床CLEAROutcomes达到主要终点MACE-4(注:MACE-4包含心脏病发作在内的脑中风、心血管死亡以及冠状动脉血运重建四种心血管发作风险。)目标,Esperion认为按照合作协议,其应收到3亿美元里程碑付款。
然而,第一三共表示拒绝,认为MACE-4风险应至少降低15%,目前这一数据为12.98%,差了2%。对此Esperion也不认同,他们认为Nexletol将心脏病发作风险率降低了27%。
双方分歧的焦点正是在于对试验终点的界定不清晰,到底是概指所有心血管事件风险,还是特指心脏病发作风险,这在早期协议中显然没有明确说明。
某资深投资人曾谈道,“BD本身就像在‘赌石’,尤其是当前越来越多的交易开始聚焦在早期甚至超早期管线,这一特性会体现地更为明显。毕竟早期分子面临的变数非常多,一旦有任何风吹草动都有可能立马终止,即便是像辉瑞这类头部MNC(跨国药企),其临床成功率也不到5%。”
如何走得更远?
国内创新药企如何在出海的路上走得更远?
据多方分析人士观点,首先,中国药企可以主打性价比,绕开美国FDA裁判权,凭借自身的成本优势切入新兴市场。比如东南亚、非洲等地区,这些市场对药价较为敏感,中国药企的性价比优势就能够得到充分发挥。为自身积累较多经验,逐步提升竞争力。
其次,通过NewCo模式深度绑定买卖双方。NewCo模式指将公司核心产品的海外权利,授权给买卖双方共同成立的海外新公司,同时引入海外基金,搭建国际化管理团队,共同运营。授权方除了约定得到首付款和里程碑款,还可以取得新公司股权,最终以新公司海外上市或被并购实现退出,以此降低管线研发失败或卖方变卦带给自身的影响。但也需警惕股权稀释及后续运营主导权问题。
第三是企业培养自身找到并开放出有价值的管线及产品的能力,将获得的现金流投入到新的研发之中,或者补充现有管线,以此搭建产品组合,逐步向兼具研发和商业化能力的制药公司迈进。
总而言之,打铁还需自身硬,想要在全球商业化道路上顺利前进,国内创新药企必须拿出在销售、疗效等方面突出的产品。