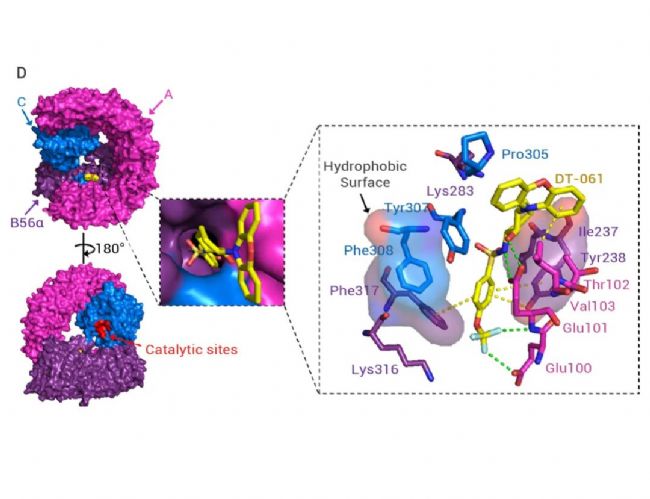
非受体型蛋白酪氨酸磷酸酶 2(PTPN2)是蛋白酪氨酸磷酸酶(PTP)家族的核心成员,通过催化蛋白质的去磷酸化反应,与蛋白酪氨酸激酶形成磷酸化 - 去磷酸化的动态平衡,成为调控细胞信号传导的核心枢纽。该分子不仅参与细胞生长、分化、凋亡等基础生命过程的精准调控,更在肿瘤发生发展与肿瘤免疫微环境调节中发挥双重关键作用,其过表达与多种癌症预后不良密切相关,而功能缺失可显著抑制肿瘤恶性进展,使其成为极具潜力的抗肿瘤新靶点。
一、分子基础:细胞信号调控的核心枢纽PTPN2 作为非受体型 PTP 家族成员,无跨膜结构域,主要定位于胞内参与信号传导调控,其核心功能依托于 PTP 与蛋白酪氨酸激酶的动态平衡体系 —— 二者通过协同调控蛋白质的酪氨酸磷酸化水平,精准控制蛋白的折叠构象、亚细胞定位、分子间相互作用及生物学活性,进而在生理与病理环境下调控细胞的各项生命活动。
在细胞基础生命过程中,这一调控机制具有不可替代性:磷酸化修饰的动态变化是细胞对外界信号的核心响应方式,PTPN2 通过特异性的去磷酸化催化,对细胞增殖、分化、凋亡等信号通路进行 “负向微调”,维持细胞内信号网络的稳态;一旦该平衡被打破,将导致细胞信号传导紊乱,进而诱发细胞异常增殖、凋亡受阻等恶性表型,为肿瘤的发生奠定分子基础。
二、肿瘤发生发展:促瘤恶性进展的关键分子PTPN2 是驱动肿瘤恶性进展的重要促瘤因子,其表达水平与肿瘤的发生、侵袭转移及患者预后直接相关。临床研究证实,PTPN2 在多种恶性肿瘤中存在显著过表达,且其表达量越高,患者的肿瘤恶性程度越高、远处转移风险越大,整体预后越差,是癌症预后评估的潜在分子标志物。
从功能机制来看,PTPN2 的促瘤效应主要通过调控肿瘤细胞的核心恶性表型实现:当 PTPN2 功能缺失时,可直接抑制肿瘤细胞的异常增殖与迁移侵袭能力,同时显著促进肿瘤细胞的程序性凋亡,从增殖、转移、凋亡三个核心维度阻断肿瘤的恶性进展;而其过表达则会通过激活肿瘤细胞的促增殖、促转移信号通路,抑制凋亡相关通路的活化,让肿瘤细胞获得无限增殖、侵袭转移的恶性特性,最终推动肿瘤的发生与进展。
三、肿瘤免疫:T 细胞功能与微环境的双重调控者PTPN2 的抗肿瘤靶点价值,更体现在其对肿瘤免疫与微环境的关键调控作用,成为连接肿瘤细胞自身恶变与肿瘤免疫微环境的重要分子节点。在免疫系统中,PTPN2 主要聚焦于 T 细胞功能调控与肿瘤微环境重塑两大方面:一方面,其可直接调控 T 细胞的活化、增殖与效应功能,影响机体抗肿瘤细胞免疫应答的强度;另一方面,PTPN2 可通过调控肿瘤微环境中免疫细胞的浸润、活化状态,以及肿瘤细胞与免疫细胞的相互作用,塑造免疫抑制性的肿瘤微环境,帮助肿瘤细胞实现免疫逃逸。
这一免疫调控特性让 PTPN2 成为肿瘤 “细胞自主调控” 与 “免疫微环境调控” 的交叉点:其不仅直接驱动肿瘤细胞的恶性转化,还通过抑制机体的抗肿瘤免疫应答,为肿瘤的生长与转移营造适宜的微环境,形成 “肿瘤细胞恶变 - 免疫抑制 - 肿瘤进一步进展” 的恶性循环,也使其成为兼具肿瘤细胞靶向与免疫调控的双重功能靶点。
四、靶点价值:抗肿瘤研发的全新方向PTPN2 在肿瘤发生与肿瘤免疫中的双重调控作用,使其突破了传统抗肿瘤靶点的单一功能局限,成为兼具细胞自主抑制与免疫激活的双重潜力靶点,为抗肿瘤药物研发提供了全新方向。
相较于传统靶向靶点,靶向 PTPN2 的治疗策略可实现双重抗肿瘤效应:一方面,通过抑制 PTPN2 的表达或活性,直接阻断肿瘤细胞的异常增殖与侵袭转移,促进肿瘤细胞凋亡;另一方面,可通过解除其对 T 细胞功能的抑制,重塑肿瘤免疫微环境,激活机体自身的抗肿瘤免疫应答,实现 “靶向杀伤肿瘤细胞 + 恢复抗肿瘤免疫” 的协同效应。这种双重作用模式既提升了抗肿瘤治疗的有效性,又为克服肿瘤耐药与免疫逃逸提供了新的思路。
目前,针对 PTPN2 的靶向研究尚处于早期阶段,其具体的信号调控网络、靶向抑制剂的设计与优化仍是研究重点。随着对 PTPN2 分子机制与肿瘤 - 免疫相互作用的深入解析,靶向该分子的抑制剂、基因编辑等治疗策略有望成为下一代抗肿瘤治疗的重要手段,为多种难治性肿瘤的治疗带来新的突破。