糖尿病致病基因鉴定发现线粒体基因突变导致代谢改变找到病因
线粒体 DNA (mtDNA) 变异会干扰线粒体功能、能量代谢、氧化应激反应甚至胰岛素分泌,从而显著影响糖尿病。m.3243 A > G 变异与母系遗传的糖尿病和耳聋 (MIDD) 有关,早发性糖尿病和听力丧失是其突出特征。其他类型的 mtDNA 变异涉及增加 2 型糖尿病易感性的基因 ND4 和 tRNA Ala 基因。了解这些变异将为开发靶向疗法以改善线粒体功能和代谢健康提供基础。佳学基因检测回顾了 mtDNA 变异对糖尿病的影响,特别是关于 m.3243 A > G 变异对线粒体功能和胰岛素分泌的影响以及其他导致糖尿病易感性的 mtDNA 变异,特别是 ND4 和 tRNA Ala 基因变异。综合了糖尿病基因检测的数据,以了解 mtDNA 变异如何影响糖尿病的发病机制。 母系遗传的糖尿病和耳聋 (MIDD)的主要缺陷是 m.3243 A > G 变异,其特征是代谢综合征和 2 型糖尿病的易感性增强,其次是线粒体功能障碍、胰岛素抵抗和 β 细胞功能障碍。据报道,其他 mtDNA 变异也通过线粒体功能障碍和胰岛素抵抗增强糖尿病易感性。线粒体功能障碍导致活性氧 (ROS) 生成增加,加剧了代谢和组织损伤。这种情况发生在对葡萄糖稳态至关重要的组织中,它代表了线粒体功能障碍对糖尿病代谢紊乱的重要贡献。这些机制将为开发靶向疗法以保护线粒体功能并改善糖尿病患者的代谢健康奠定理论基础。
糖尿病致病基因鉴定发现线粒体基因突变导致代谢改变找到病因关键词:线粒体 DNA、ATP 生成、遗传变异、生物标志物、代谢紊乱
亮点•
mtDNA 中的关键突变是 m.3243A > G。此类突变会因胰岛素分泌紊乱而损害线粒体功能,使人们更容易患上 2 型糖尿病和 MIDD。
•
机制包括破坏平均细胞能量产生和控制氧化应激,例如细胞内钙信号传导以及随后的代谢功能障碍和胰岛素抵抗。
•
mtDNA 突变还容易引发并发症,包括糖尿病肾病、视网膜病变和心血管并发症,从而减轻糖尿病的严重程度。糖尿病基因解码模型动物和细胞培养模型已经确定了受 mtDNA 突变影响的分子通路,从而为新型糖尿病治疗提供了潜在靶点。
•
了解线粒体DNA在糖尿病中的作用不仅有助于了解疾病的机制,而且还为靶向治疗开辟了途径。这可以显著改善线粒体的功能和代谢健康,为更有效的糖尿病治疗带来希望。
1. 佳学基因检测为什么要进行糖尿病专项基因解码基因检测?糖尿病是一种以血糖升高为特征的代谢紊乱,其原因是胰岛素分泌缺陷、胰岛素作用缺陷或两者兼有缺陷。糖尿病分为几种类型,1 型糖尿病是由胰腺 β 细胞的自身免疫性破坏导致胰岛素缺乏所致,2 型糖尿病则是由胰岛素抵抗和胰岛素分泌不足共同引起的。其他类型包括在怀孕期间发生的妊娠期糖尿病和由单个基因变异引起的单基因糖尿病。线粒体是负责能量产生的细胞器,在葡萄糖代谢中起着至关重要的作用。这些细胞器通过氧化磷酸化 (OXPHOS) 生成三磷酸腺苷 (ATP),这个过程涉及电子传递链。除了产生能量之外,线粒体还调节各种细胞过程,包括钙信号传导、细胞凋亡和 ROS 产生。这些细胞器的功能障碍会破坏细胞稳态,导致糖尿病等代谢紊乱的发展。线粒体 DNA 是一种独立于核 DNA 的小环状基因组,它编码了线粒体功能所必需的基因,包括参与 OXPHOS 的基因。mtDNA 的变异会损害线粒体功能,导致 ATP 生成减少、ROS 生成增加,以及细胞代谢改变 。在糖尿病方面,mtDNA 变异与该疾病的发病机制和并发症的发展都有关。糖尿病基因解码表明,特定的 mtDNA 变异,如 m.3243 A > G 变异,与女性患妊娠期糖尿病和妊娠并发症的风险增加有关。此外,外周血细胞的线粒体功能障碍与糖尿病患者的血糖控制不佳和骨密度降低有关。干细胞培养糖尿病基因解码进一步强调了线粒体DNA变异对细胞和分子改变的影响,为潜在的治疗策略提供了见解。这些变异可以作为糖尿病基因解码变异效应的模型和细胞替代疗法的来源,为未来糖尿病治疗糖尿病基因解码提供了有希望的途径。
了解线粒体DNA变异在糖尿病中的作用对于开发靶向治疗和干预措施至关重要。佳学基因解码基因检测旨在全面概述目前关于糖尿病线粒体DNA变异的知识,重点关注其类型、患病率、对线粒体功能和细胞代谢的影响,以及它们对糖尿病相关并发症发展的贡献。此外,佳学基因解码基因检测探讨线粒体DNA变异在糖尿病中的诊断和预后意义。它将讨论线粒体DNA分析作为疾病风险分层和监测的生物标志物的潜在用途。佳学基因解码基因检测还将讨论针对糖尿病线粒体功能障碍的新兴治疗策略,以及将这些发现转化为临床实践的挑战和机遇。佳学基因解码基因检测的目的是促进线粒体生物学和糖尿病病理生理学的发展。通过阐明线粒体DNA变异在糖尿病中的作用,佳学基因解码基因检测旨在为开发新的治疗方法以减轻糖尿病线粒体功能障碍的影响铺平道路。了解线粒体DNA变异与糖尿病之间的分子机制对于开发针对性治疗方法和改善患者预后至关重要。
1.1. 线粒体的代谢功能和功能障碍线粒体在细胞代谢中起着重要作用,特别是在能量产生和各种代谢途径中。以下是线粒体代谢功能的一些关键方面,如能量产生、β-氧化、柠檬酸循环(克雷布斯循环)、代谢物穿梭、钙稳态、血红素生物合成、ROS 产生和抗氧化防御、细胞凋亡等。线粒体功能障碍可导致各种代谢紊乱,包括糖尿病、神经退行性疾病和心血管疾病。Markin 等人的糖尿病基因解码评估了线粒体功能障碍在动脉粥样硬化和糖尿病等慢性人类疾病中的作用。它强调了线粒体周转过程(如裂变、融合和线粒体自噬)在维持细胞内功能性线粒体群方面的重要性。这些过程的功能障碍会导致线粒体功能障碍的积累、能量产生不足、氧化应激增加和细胞死亡。动脉粥样硬化中的线粒体功能障碍,mtDNA 变异会导致动脉粥样硬化病变的形成。线粒体功能下降会促进衰老过程和与年龄相关的疾病。此外,白色脂肪组织会增加能量消耗,人们正在糖尿病基因解码它对糖尿病和动脉粥样硬化等代谢疾病的影响。Baishali Alok Jana 等人的糖尿病基因解码检查了细胞质脂质过量、线粒体功能障碍和骨骼肌胰岛素抵抗之间的联系,特别是在高脂饮食引起的代谢紊乱的情况下。表明过量的脂质会在组织中积聚并会对葡萄糖稳态产生负面影响。尽管在 2 型糖尿病中观察到线粒体功能障碍,但它是否是胰岛素抵抗的原因或结果尚不清楚,并探索连接细胞浆脂质过量和线粒体功能障碍的分子途径,包括活性氧、衰老和骨骼肌中线粒体生物合成的减少。线粒体糖尿病 (MD) 是一种罕见的单基因糖尿病,主要特征是由于线粒体 ATP 生成受损导致胰腺 β 细胞胰岛素分泌衰竭。然而,它也与临床特征胰岛素抵抗 (IR) 有关。线粒体功能障碍是导致 IR 的一个关键因素,表明线粒体在 MD 中起着双重作用。该综述讨论了 IR 的胰岛素信号传导和分子机制,强调了线粒体在细胞葡萄糖代谢和胰岛素分泌中的重要性。它还讨论了与糖尿病相关的已证实的致病性 mtDNA 变异,特别是线粒体基因组的转移 RNA (tRNA) 基因中的变异。佳学基因解码基因检测表明,MD 中的线粒体功能障碍不仅可能导致 ATP 生成受损,还可能导致 IR,可能是通过 tRNA 基因中牛磺酸修饰的异常实现的。文章强调了线粒体在糖尿病发展中的重要作用,需要进一步糖尿病基因解码以了解与 IR 和糖尿病相关的线粒体功能障碍的确切机制。
Cagla Cömert 等人的糖尿病基因解码糖尿病基因解码了两种 mtDNA 变异 T10609C 和 C10676G 对线粒体呼吸复合体 I 中质子易位机制的影响。这些变异破坏了质子易位途径,导致线粒体功能障碍和活性氧生成增加。糖尿病基因解码表明,这些变异可以作为 2 型糖尿病 (T2DM) 和白内障的特定遗传生物标志物,计算分析可能验证这些生物标志物。同源重组缺陷 (HRD) 及其对 PARP 抑制剂 (PARPi) 的影响表明,HRD 癌细胞从糖酵解转向氧化代谢,依靠氧化磷酸化 (OXPHOS) 进行 DNA 修复。这种适应使它们对二甲双胍和 NAD+ 水平更敏感。相反,高糖酵解代谢会降低 PARPi 的有效性。糖尿病基因解码表明癌细胞代谢状态,特别是对 OXPHOS 的依赖,会影响它们对 PARPi 的反应,这提示了改善 PARPi 在 HRD 癌症中的有效性的潜在策略。糖尿病基因解码还表明,线粒体和核基因的变异会导致功能障碍。由于线粒体在调节 β 细胞胰岛素分泌中起着至关重要的作用,而该过程中的功能障碍是糖尿病的标志。线粒体裂变和融合动力学异常与该疾病有关,糖尿病患者体内某些蛋白质的水平改变就是明证。进一步证明,孤儿核受体的 Nr4a 家族对线粒体功能至关重要,其过表达可诱导胰腺 β 细胞增殖。氧化磷酸化 (OXPHOS) 功能受损导致胰岛素抵抗中的 β 细胞功能障碍,这意味着原发性线粒体疾病很少见,线粒体缺陷与糖尿病等常见疾病有关 。 MT-ND1基因中的非同义 mtDNA 变异存在于糖尿病患者中。 这些变异导致线粒体呼吸链复合物 I 功能障碍,从而导致活性和数量下降。 这表明,线粒体功能障碍可能导致糖尿病的发展,而糖尿病通常是由于葡萄糖代谢和胰岛素分泌失衡造成的。 这些发现为线粒体功能障碍与糖尿病之间的潜在联系提供了深刻的见解,强调了了解线粒体缺陷在糖尿病发病机制中的分子机制的重要性。 这些见解凸显了对旨在改善线粒体功能的靶向疗法的需求,这可能在预防或治疗糖尿病方面发挥关键作用。
1.2. 线粒体DNA变异与不同人群中的糖尿病相关在不同的人群中,线粒体DNA变异与糖尿病(DM)的病理生理学有关。据推测,亚洲印度人群中的线粒体DNA A10398G多态性会影响线粒体功能,进而导致β细胞功能障碍和胰岛素抵抗。它存在于电子传递链(ETC)复合物I的ND3基因中。线粒体DNA 16,189 T > C变异与2型糖尿病发病率较高有关。这种变异位于线粒体DNA D环区,可能对线粒体DNA的转录和复制产生影响,从而损害葡萄糖代谢并导致中国人的线粒体功能障碍。线粒体DNA单倍群J与2型糖尿病的高风险有关,而单倍群H与较低的风险有关。人们认为这些单倍群会影响欧洲人的线粒体功能和能量代谢。 2 型糖尿病风险的增加与ND2基因中的 tDNA 5178 A > C 多态性有关。已证明这种多态性可降低氧化应激并损害线粒体功能,这可能有助于日本人和糖尿病及其并发症的较高风险与MT-TL1基因 mtDNA 3243 A > G 变体有关。在非洲人中,这种变异会损害线粒体 tRNA 的功能,导致线粒体蛋白质合成和能量产生减少。此外,许多糖尿病基因解码表明,mtDNA 与不同人群的糖尿病有关。
Freeney 等人的糖尿病基因解码检查了 m.3243 A > G 变异对线粒体疾病女性妊娠结局的影响。该糖尿病基因解码涉及 67 名确诊线粒体疾病的女性和 69 名未患病的女性。结果显示,携带 m.3243 A > G 变异的孕妇患妊娠糖尿病、呼吸困难和高血压的几率更高。这些孕妇中只有一半可以正常阴道分娩,许多孕妇需要紧急剖腹产。携带 m.3243 A > G 变异的母亲所生的婴儿出生较早,出生体重较轻。这些婴儿中有一半以上是早产儿,需要复苏并送入特殊护理婴儿病房。糖尿病基因解码得出结论,携带 m.3243 A > G 变异的女性在妊娠期间发生并发症的风险更高,包括剖腹产和早产,这凸显了对患有线粒体疾病的孕妇进行专门护理的必要性糖尿病患者的线粒体 DNA、功能和临床严重程度的 m.3243 A > G 变异发现外周血单核细胞存在严重的线粒体功能障碍,并且与血糖控制较差和骨密度降低有关。该糖尿病基因解码强调了线粒体功能在糖尿病中的重要性,并建议测量异质体水平和评估线粒体膜电位有助于评估糖尿病的严重程度。
Tabebi 等人的糖尿病基因解码重点是线粒体糖尿病 (MD),这是一种罕见的单基因糖尿病,其特征是家族聚集性和携带者的双侧听力障碍。最常见的 MD 形式与线粒体MT-TL1基因中的 m.3243 A > G 变异有关,但 mtDNA 中的其他变异、缺失和耗竭也与 MD 有关。糖尿病基因解码发现一个具有 MD 临床特征的家族,包括心肌病、视网膜病变和精神运动迟滞。先证者具有异质体状态的 m.3243 A > G 变异、大量 mtDNA 缺失和 mtDNA 拷贝数减少。该变异影响氧化磷酸化和 ATP 产生,导致线粒体功能障碍。先证者的其他线粒体变异,如 MT-ND1 和MT-ND6基因的替换,与糖尿病和耳聋有关。该糖尿病基因解码强调了与 m.3243 A > G 变异相关的复杂表型和线粒体基因组异常在 MD 中的重要性Yagil 等人的糖尿病基因解码使用 Cohen 糖尿病大鼠模型糖尿病基因解码了线粒体在糖尿病发展中的作用。他们发现了NDUFA4基因中的一种变异,这种变异导致 NDUFA4 蛋白的缺失,从而影响线粒体功能。糖尿病基因解码发现,暴露于致糖尿病饮食的糖尿病大鼠的线粒体复合物 I 和复合物 IV 活性降低,表明饮食对复合物 IV 的影响与基因变异无关。糖尿病大鼠的 ATP 水平未能因饮食而增加,这表明变异与代谢菌株相结合阻止了预期的 ATP 产生增加,而 ATP 产生对于胰腺分泌胰岛素至关重要。糖尿病大鼠也表现出氧化应激升高,表明变化引起的线粒体功能障碍,再加上饮食的代谢压力,导致氧化应激增加,损害胰岛素分泌并导致糖尿病发展。
1.3. 妊娠期糖尿病(GDM)和线粒体功能障碍由于母体代谢负担影响母亲和婴儿的健康,线粒体功能障碍与妊娠期糖尿病之间的关系越来越受到关注。已证明线粒体DNA突变会导致孕妇线粒体功能受损,这可能会使孕妇因葡萄糖代谢和细胞能量产生中断而易患妊娠期糖尿病;胰岛素信号传导的干扰是一种氧化应激事件,导致妊娠期糖尿病特有的胰岛素抵抗状态。
Alharbi 等人的糖尿病基因解码调查了沙特女性的 GDM 与常见线粒体变异之间的联系。糖尿病基因解码人员对 96 名 GDM 和 102 名非 GDM 孕妇进行了病例对照糖尿病基因解码,分析了 DNA 中的这些基因变异。他们未在任何受试者中发现异质体或纯合变异,这表明这些变异在沙特女性的 GDM 中不起作用。GDM 的特征是妊娠期葡萄糖不耐受,与氧化应激和线粒体功能障碍有关。该糖尿病基因解码表明,需要进一步进行荟萃分析,以更好地了解 GDM 与线粒体变异之间的整体关系。Zhang 等人的糖尿病基因解码探讨了 TRAP1 在抑制 MARCH5 介导的 MIC60(一种对线粒体嵴结构至关重要的蛋白质)降解中的作用,以防止糖尿病条件下心肌细胞的线粒体功能障碍和凋亡。糖尿病基因解码人员发现,高糖/棕榈酸条件导致线粒体功能障碍和细胞凋亡,泛素化和降解导致 MIC60 水平降低。外源表达 MIC60 改善了嵴结构、线粒体功能并减少了细胞凋亡。破坏 MIC60 和 MARCH5 之间的相互作用或沉默 MARCH5 可阻止 MIC60 降解并减轻功能障碍。线粒体伴侣 TRAP1 通过与 MARCH5 竞争结合来抑制 MIC60 泛素化。Kim 等人的糖尿病基因解码探讨了锌转运蛋白 8 (ZnT8) 在 1 型糖尿病 (T1D) 中的作用。糖尿病基因解码人员发现,ZnT8 的完全缺失会加速 T1D 的发病,而杂合性则部分保护它。ZnT8 缺乏导致更为猖獗的自身免疫,表明其在调节免疫反应中发挥作用。糖尿病基因解码还发现,改变胰岛内锌稳态来调节线粒体呼吸可能是调节 1 型糖尿病病理生理的一种新方法。Schartnera 等人的糖尿病基因解码发现,高血糖水平会降低 SIRT2 表达,导致线粒体功能受损,并抑制感觉神经元的神经突生长。使用特定抑制剂抑制多元醇通路可恢复 SIRT2 表达并改善线粒体功能,这表明增强 SIRT2 信号传导可能是糖尿病神经病变的潜在治疗策略。
1.4. 线粒体DNA变异在糖尿病发病机制中的作用线粒体功能受损是能量代谢和细胞稳态中的一个重要问题,因为它通过线粒体 DNA 变异在糖尿病的发病机制中起着关键作用。m.3243 A > G 变异通常会导致母系遗传的糖尿病和耳聋,它会增加 β 细胞的胰岛素抵抗和功能障碍。m.3243 A > G 变异仅影响线粒体蛋白质合成,导致三磷酸腺苷 (ATP) 生成缺陷和活性氧 (ROS) 增加。这些异常的线粒体生物能量学可能导致代谢紊乱,导致 2 型糖尿病,从而确立了线粒体 DNA 变异在糖尿病病理生理学中的关键作用。
更为复杂的是,线粒体DNA中其他基因的变异,如ND4和tRNA Ala,通过不同的机制增加了糖尿病的整体易感性。例如,ND4的变异与过量ROS的产生有关,而过量ROS会降低线粒体膜电位,导致胰岛素分泌受损。同样,tRNA的变异会破坏线粒体蛋白质的合成,而这对于维持电子传递链的完整性和有效的ATP生成至关重要。这表明,mtDNA变异通过多方面的机制导致糖尿病的发病,因此,在糖尿病基因解码线粒体功能障碍在糖尿病发展中的作用时,不仅需要包括对胰岛素分泌的直接影响,还需要包括对细胞代谢的更广泛影响。
1.4.1. 线粒体功能障碍可能导致胰岛素分泌和胰岛素抵抗胰岛素分泌和抵抗都是糖尿病发生的重要事件,线粒体功能障碍也与此有关。在胰腺β细胞中,胰岛素分泌过程必须基于 ATP 生成进行调节,ATP 会驱动胰岛素颗粒的胞吐。已证实 m.3243 A > G 变异体可降低线粒体的 ATP 生成水平,而该水平不足以直接降低胰岛素分泌。
此外,m.3243 A > G 变异会破坏胰岛素从β 细胞外排的关键钙信号,从而加剧葡萄糖稳态的紊乱。这不仅会削弱β 细胞对葡萄糖的短期反应,还会导致β 细胞的长期功能障碍,从而加剧糖尿病特有的高血糖状态 。另一方面,大多数线粒体DNA变异,特别是编码ND4和tRNA的基因,会对胰岛素抵抗的产生产生重大影响。这与线粒体功能障碍(涉及ROS生成水平增强)以及外周组织引发的胰岛素抵抗有关。特别是,ROS 增加会破坏胰岛素信号通路,从而削弱胰岛素诱导肌肉和脂肪组织吸收葡萄糖的作用。因此,各种线粒体DNA变异对糖尿病病理生理的影响存在明显差异。例如,其中一些变异主要与胰岛素分泌受损有关,而另一些则参与胰岛素抵抗的表现。了解这些其他机制将有助于设计有针对性的治疗方法,旨在恢复线粒体功能并显著降低这些变异对糖尿病发病机制的影响。总之,线粒体DNA变异在糖尿病的发病机制中具有重要意义。它们会损害胰岛素分泌和与胰岛素抵抗相关的机制。特别是,变异 m.3243 A > G、ND4 和 tRNA Ala 在糖尿病发病机制中的作用解释了与代谢调节有关的线粒体功能障碍的并发症。因此,进一步糖尿病基因解码此类机制对于发现新的治疗靶点至关重要,这些靶点有助于改善糖尿病患者的治疗效果。阐明这些变异的不同贡献有助于理解线粒体健康与糖尿病之间通常复杂的相互作用。
1.5. 与糖尿病并发症相关的线粒体DNA变异线粒体异常在糖尿病并发症的发展中起着重要作用,尤其是微血管和大血管问题。线粒体DNA突变,例如基因MT-TL1和ND5中的突变,已被证明会通过损害氧化磷酸化(OXPHOS)和增加ROS产生,加剧糖尿病肾病、视网膜病变和周围神经病变等疾病。这些影响会损害血管完整性和细胞能量供应,加剧糖尿病并发症的进展。
有多项糖尿病基因解码调查了线粒体DNA变异在糖尿病(DM)相关并发症的发展和进展中的作用,特别是引起微血管和大血管并发症的线粒体DNA变异,即线粒体DNA 3243 A > G变异(MT-TL1基因)、线粒体DNA 8993 T > G变异(ATP6基因)、线粒体DNA 13513G > A变异(ND5基因)、线粒体DNA缺失和线粒体DNA单倍型。在这里,佳学基因糖尿病基因检测总结了与线粒体DNA与糖尿病不同并发症相关的糖尿病基因解码。
Gazdikova 等人的糖尿病基因解码检查了线粒体在肾脏疾病中的作用,特别是慢性肾脏疾病 (CKD) 和糖尿病中的急性肾损伤 (AKI)。线粒体对于能量产生、氧化还原信号和炎症至关重要,其功能障碍与各种肾脏疾病有关。糖尿病基因解码表明,CKD 中的线粒体缺陷会导致肾小管综合征、间质性肾炎、局灶性和节段性肾小球硬化以及糖尿病肾病。CKD 中的线粒体功能障碍会导致肌肉无力和萎缩,这种疾病被称为“获得性线粒体肌病”和尿毒症性肌肉减少症。在 AKI 中,线粒体是能量来源和细胞死亡的调节器,导致肾小管损伤和持续性肾功能不全。该糖尿病基因解码表明,了解线粒体在肾脏疾病中的作用可以改善线粒体肾病或肾损伤患者的诊断和治疗。
一名 57 岁的日本男性患有 MIDD,由于诊断延迟而患上慢性肾病 (CKD)。肾活检显示肾小管上皮细胞线粒体变性,足细胞和肾小管细胞中线粒体积聚,表明存在线粒体功能障碍。尽管血糖控制良好且无高血压,但患者在 20 余年间患上了肾硬化症。没有典型的糖尿病肾病病变表明线粒体细胞病变导致了 CKD 进展。开始使用牛磺酸补充剂治疗以防止病情进一步恶化。该病例强调了对于患有非典型糖尿病相关并发症的患者考虑线粒体功能障碍的重要性,尤其是当涉及肾脏疾病时。Ryang Na 等人的糖尿病基因解码检查了线粒体氧化磷酸化 (OxPhos) 在足细胞功能障碍中的作用,足细胞功能障碍是原发性和糖尿病性肾小球疾病的常见症状。他们使用了携带CRIF1基因功能丧失变异的小鼠模型,该基因对于OxPhos多肽的产生和插入线粒体膜至关重要。糖尿病基因解码结果显示,足细胞中CRIF1缺乏导致线粒体功能障碍、结构异常和严重的白蛋白尿,并在20周时发展为肾小球硬化和间质纤维化。该糖尿病基因解码强调了线粒体OxPhos功能在维持足细胞完整性方面的重要性。Wang等人的糖尿病基因解码发现,线粒体功能障碍是足细胞损伤的重要因素,而足细胞损伤是糖尿病肾病蛋白尿的关键因素。糖尿病基因解码发现,在糖尿病条件下,Cdk5表达和活性上调,导致以突触足蛋白和肾素表达减少以及线粒体结构和功能功能障碍为特征的足细胞损伤。抑制 Cdk5 可降低 ROS 水平、减少细胞色素c释放和增加 ATP 生成,从而减轻足细胞损伤并改善线粒体功能。该糖尿病基因解码还强调了 Cdk5 介导的 Sirt1 磷酸化在糖尿病肾病的线粒体功能障碍和足细胞损伤中的作用,表明针对 Cdk5-Sirt1 信号通路可能是一种潜在的治疗策略。
该糖尿病基因解码探讨了外周动脉疾病 (PAD) 患者(尤其是合并糖尿病的患者)的 mtDNA 异质体、线粒体功能和临床严重程度之间的联系。糖尿病基因解码人员假设,糖尿病和 PAD 患者的 mtDNA 异质体水平更高,尤其是在易受氧化损伤影响的区域,这与缺血和活动障碍有关。糖尿病基因解码发现,PAD 和糖尿病患者的肌肉中“低频”异质体水平更高,尤其是在位移环等区域。线粒体损伤较低(以低 mtDNA 拷贝数和微异质体为标志)与合并糖尿病的 PAD 患者更好的行走表现相关。Oishi 等人的糖尿病基因解码检查了一名因线粒体 DNA 变异而患有 母系遗传的糖尿病和耳聋 (MIDD)的患者。该患者患有神经性听力损失、糖尿病和黄斑营养不良。高分辨率成像技术显示,在 母系遗传的糖尿病和耳聋 (MIDD)中,中央凹的原发性光感受器功能障碍可能先于视网膜色素上皮功能障碍发生,这表明光感受器的线粒体功能障碍可能导致黄斑营养不良。该糖尿病基因解码强调了全外显子组测序在检测 母系遗传的糖尿病和耳聋 (MIDD)中线粒体 DNA 变异的重要性。Peppel 等人的糖尿病基因解码讨论了 母系遗传的糖尿病和耳聋 (MIDD)和伴有乳酸性酸中毒和中风样发作的线粒体脑肌病 (MELAS) 疾病的临床表型的异质性,这些疾病可归因于不同组织中不同程度的异质体。脑中异质体水平高会导致 MELAS,而胰腺中异质体水平高会导致糖尿病。糖尿病基因解码表明,有症状的 MELAS 患者的脑组织始终显示异质体水平 >70%。然而,由于这些水平会随着年龄的增长而变化和下降,因此在将这些水平与临床结果相关联时需要谨慎。 母系遗传的糖尿病和耳聋 (MIDD)的严重程度和进展可能受到性别、环境因素和遗传修饰等因素的影响。未来的糖尿病基因解码需要开发一个更全面的模型来预测 母系遗传的糖尿病和耳聋 (MIDD)表型的严重程度和进展。Katie Nahay Robinson 等人的糖尿病基因解码讨论了 MIDD,这是一种由线粒体 DNA 中的点变异引起的罕见糖尿病综合征。母系遗传的糖尿病和耳聋 (MIDD)主要通过母体卵母细胞遗传,可导致糖尿病、耳聋和器官特异性并发症。管理 母系遗传的糖尿病和耳聋 (MIDD)需要采用多学科方法,包括筛查合并症、选择合适的治疗方法和提供遗传咨询。治疗策略针对线粒体功能障碍和胰岛素缺乏,胰岛素促泌剂是首选的口服降糖药。母系遗传的糖尿病和耳聋 (MIDD)的视网膜表现与传统的糖尿病相关并发症不同,患者经常会出现黄斑营养不良和视网膜病变。
Sahara 等人的糖尿病基因解码报告了一名患有严重双侧神经性听力损失 (SNHL) 的患者,该患者左耳接受了人工耳蜗植入 (CI)。A8296G 变异罕见但与听力损失有关,糖尿病基因解码发现该变异对患者的听力和言语辨别有益。这些发现强调了线粒体遗传学在理解听力损失及其进展方面的重要性,表明患有这种变异的 SNHL 患者可能受益于 CI。Saku 等人的糖尿病基因解码检查了三例患有 m.3243 A > G 变异的线粒体心肌病病例,发现有心脏肥大、青少年型糖尿病和听力损失。不同病例的心脏受累严重程度和症状持续时间各不相同。组织学分析显示,线粒体变性可能与线粒体心肌病患者的心脏功能受损有关,表明线粒体变性导致心力衰竭进展。潘国栋等人对钠-葡萄糖协同转运蛋白 2 抑制剂恩格列净 (EMP) 及其对 ALDH2 * 2 突变小鼠糖尿病性心肌病的影响进行了糖尿病基因解码。这些小鼠是 ALDH2 中 E487K 变异的东亚人的模型,用 2 型糖尿病诱发,并用 EMP 治疗两个月。糖尿病基因解码发现,EMP 改善了心脏功能和运动表现,这归因于它能够减少心脏线粒体中的蛋白质加合物并增加骨骼肌中的 AKT-AS160-GLUT-4 信号传导 [ 54 ]。该糖尿病基因解码调查了蛋白激酶 R 样内质网激酶 (PERK) 在 Wolcott-Rallison 综合征(一种以早发性糖尿病为特征的疾病)心脏瓣膜形成中的作用。糖尿病基因解码人员发现,PERK 抑制通过影响脂肪酸氧化和心内膜间质转化来抑制线粒体代谢活动。这表明 PERK 信号对于心脏瓣膜形成至关重要,凸显了线粒体功能在糖尿病相关心脏并发症中的作用。
2.糖尿病视网膜病变糖尿病视网膜病变 (DR) 是糖尿病的主要微血管并发症,其特征是视网膜血管受损,可导致视力丧失。与其他组织相比,视网膜细胞对氧气的需求较低,因此在某些 DR 病例中,视网膜细胞的进展可能较慢。如文献中讨论的那样,这一假设强调了线粒体功能障碍和氧化应激在视网膜病理中的复杂相互作用。很少有糖尿病基因解码强调,与其他组织相比,视网膜微血管环境独特,氧气提取率低,导致血管功能障碍的征兆延迟出现。光学相干断层扫描血管造影 (OCTA) 显示了细微的微血管异常,例如灌注密度和血管密度降低,这些异常先于明显的糖尿病视网膜病变出现。此外,慢性肾病、血脂异常和高血糖等全身性因素会显著影响视网膜微血管变化。这对于理解为什么糖尿病视网膜病变会根据个体全身状况而以不同的方式进展尤为重要。因此,较低的氧需求与视网膜某些区域代谢压力降低的发现相一致,可能延缓了临床症状的出现。
Manish Mishra 等人的糖尿病基因解码表明,线粒体 DNA 甲基化和碱基错配在糖尿病视网膜病变的发展中至关重要。在糖尿病视网膜病变中,视网膜线粒体表现出功能障碍,并且由于碱基错配增加和胞嘧啶高甲基化(特别是在位移环区域)而导致线粒体 DNA 受损。糖尿病基因解码人员利用人视网膜内皮细胞和糖尿病小鼠模型抑制 DNA 甲基化并调节胞嘧啶脱氨因子。他们发现,抑制 DNA 甲基化或调节脱氨因子可显著减少 D 环处的碱基错配并防止线粒体功能障碍。这种串扰即使在高血糖终止后仍会持续存在,表明其在与糖尿病视网膜病变进展相关的代谢记忆现象中发挥作用。
线粒体功能障碍会促进活性氧 (ROS) 的产生,导致氧化损伤和炎症,从而显著促进 DR 的发病。关键的线粒体 DNA 变异(如 m.3243 A > G)与视网膜细胞的线粒体功能受损有关,从而加剧血管渗漏和新生血管形成。新兴糖尿病基因解码强调了线粒体表观遗传变化(包括线粒体 DNA 甲基化)在延续“代谢记忆”现象中的作用,这种现象即使在血糖得到控制后仍会持续存在视网膜损伤。了解这些机制有助于确定预防或减轻 DR 的治疗靶点。
3.大血管并发症糖尿病中的线粒体功能障碍还会导致大血管并发症,包括心血管疾病 (CVD)、动脉粥样硬化和外周动脉疾病。这些并发症是糖尿病患者发病率和死亡率的重要因素。线粒体氧化磷酸化 (OXPHOS) 受损会破坏 ATP 的产生,导致内皮功能障碍、ROS 生成增加和慢性炎症 - 这些都是动脉粥样硬化的主要驱动因素。
糖尿病基因解码已发现特定的线粒体DNA变异,如ND4和ND5基因中的变异,它们通过促进氧化损伤而增强对动脉粥样硬化斑块形成的敏感性。线粒体功能障碍还会改变脂质代谢,导致脂质在血管壁内积聚和泡沫细胞形成。这些过程强调了线粒体异常对糖尿病的系统性影响,并强调需要针对线粒体健康的综合治疗策略来对抗大血管并发症。
3.1. 与线粒体DNA变异相关的动物糖尿病基因解码动物糖尿病基因解码为了解这些变异对线粒体功能和疾病的影响提供了宝贵的见解。与糖尿病相关的线粒体DNA变异主要糖尿病基因解码了小鼠的CRIF1缺乏症、糖尿病肾病中的Cdk5表达、ALDH2*2突变小鼠、小鼠的线粒体心肌病。表明动物糖尿病基因解码对于了解线粒体DNA变异在糖尿病中的病理生理学和机制作用更为重要。这里佳学基因糖尿病基因检测列出了通过动物模型了解分子通路的糖尿病基因解码。糖尿病基因解码列表于表2中。(见图1)
表 2.动物糖尿病基因解码显示了线粒体DNA变异与糖尿病的关系。研究变体动物模型影响Adams 等人CRIF1 缺乏症NOD小鼠模型线粒体功能障碍可能影响 1 型糖尿病的发病机制,从而带来新的治疗途径Dumesic 等人PPARGC1A基因中的 uORF 变体小鼠模型PGC1a 蛋白水平升高、氧化代谢增强、预防急性肾损伤,对糖尿病、神经退行性疾病、癌症和肾脏疾病等疾病有重要意义Herbst 等人不适用年龄较大的大鼠二甲双胍增加了线粒体DNA拷贝数,减少了心脏质量,并降低了心脏中线粒体复合物I依赖的呼吸作用Kunath 等人Nnt基因截短C57BL/6 J 小鼠野生型小鼠对饮食引起的肥胖更敏感,相对脂肪量更高Y. Li 等人不适用GK大鼠高血糖激活Cdk5,导致海马区AMPK-a2Thr485磷酸化,抑制AMPK-a2活性,降低神经元增殖和活力刘等人不适用小鼠模型乙氧基喹 (EQ) 治疗可改善糖尿病小鼠坐骨神经的神经传导并减少线粒体 DNA 缺失McCrimmon 等人CrAT 部分缺失异质体小鼠模型完整的线粒体底物流出在预防肾脏疾病中的重要性,以及对线粒体功能障碍反应的性别差异Pan 等人ALDH2*2 变体ALDH2*2 突变小鼠ALDH2 激活可防止 4HNE 诱发的冠状动脉内皮细胞损伤和心脏功能障碍Pittala 等人不适用小鼠模型基于 VDAC1 的肽可恢复血糖水平、增加胰岛大小和数量、改善胰岛素含量Tang 等人MPV17 缺乏症Mpv17 缺陷小鼠MPV17 自主促进 β 细胞凋亡,抵抗因 β 细胞丢失和凋亡引起的糖尿病王等人不适用II型糖尿病小鼠鸢尾素治疗可改善胰岛素敏感性、葡萄糖耐受性、维持心脏功能,与激活 p38 通路和减少 HDAC4 有关Tate 等人不适用秋田鼠MitoGamide 改善糖尿病小鼠左心室舒张功能障碍标志物,针对线粒体功能障碍Yagil 等人NDUFA4基因缺失糖尿病大鼠NDUFA4基因缺失导致线粒体复合物 I 和 IV 活性降低、ATP 生成减少、氧化应激增加Turchi 等人FXN基因变异小鼠模型(KIKO)vWAT 中 FXN 的缺乏会导致脂肪细胞扩张、血管减少、促炎性脂肪因子、免疫细胞募集和纤维化,类似于 2 型糖尿病图 1.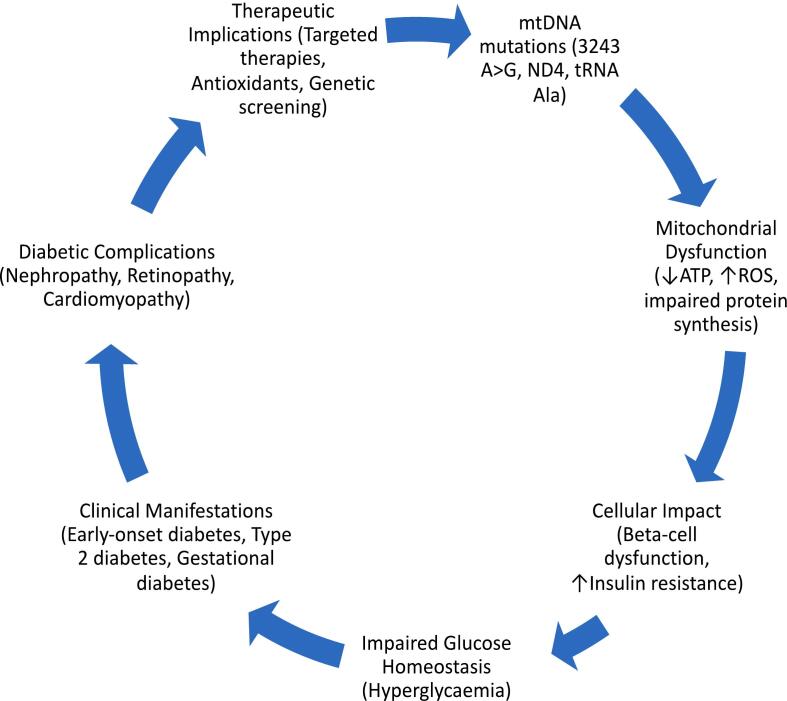
Schwartz 等人对秀丽隐杆线虫的糖尿病基因解码表明,原始生殖细胞 (PGC) 通过两种机制对线粒体 DNA 的数量和质量进行独特的调节:PGC 叶的相互蚕食与一般的自噬相结合以减少线粒体 DNA 总量,以及 PINK-1 介导的突变线粒体 DNA 异质体减少以提高线粒体 DNA 质量。这种双重调节确保了在生殖系扩增和分化之前线粒体的最佳创始群体。线粒体 DNA 数量的减少会将线粒体 DNA 拷贝数重置为 200 左右,这在生殖系干细胞 (GSC) 复制时会主动维持。PINK-1 在降低 PGC 中突变线粒体 DNA 的比例方面发挥作用,可能将它们永久地从生殖系中消除。 Sarah Weksler-Zangen 等人的糖尿病基因解码表明,糖尿病与线粒体功能障碍有关,尤其是在遗传性线粒体疾病中。线粒体相关糖尿病的严重程度取决于具体变异和受影响的线粒体拷贝水平。筛查家庭成员是否患有糖尿病至关重要,因为糖尿病可能表现出不同的特征和并发症。治疗患有线粒体疾病的糖尿病具有挑战性,因为二甲双胍是 2 型糖尿病的一线治疗药物,由于存在乳酸酸中毒的风险,因此不推荐使用。相反,SGLT-2 抑制剂和线粒体 GLP-1 相关物质是首选。表明线粒体功能障碍是人类 2 型糖尿病的主要缺陷的证据有限。此外,最近对科恩糖尿病敏感 (CDs) 大鼠的糖尿病基因解码强调了线粒体呼吸链酶细胞色素c氧化酶 (COX) 在调节 GSIS 中的作用。这表明胰岛-COX 缺乏是导致糖尿病的主要缺陷。进一步糖尿病基因解码 COX 和糖尿病中的其他线粒体因素可能会为诊断和治疗患有线粒体疾病和线粒体功能障碍的糖尿病患者带来新方法。
3.2. 靶向药物治疗方案钠-葡萄糖协同转运蛋白 2 (SGLT2) 抑制剂因其对心血管和肾脏有益而被广泛用于治疗糖尿病。然而,新出现的证据表明,这些药物可能会加剧肌肉萎缩和体重减轻,尤其是对于易患肌肉减少症的患者 。SGLT2抑制剂可能会增加胰高血糖素水平并促进脂肪分解,从而可能通过降低胰岛素介导的骨骼肌合成代谢作用而导致肌肉萎缩。
此外,糖尿病加剧了肌肉细胞的线粒体功能障碍,可能会加剧这些影响。ATP 生成减少和氧化应激增加会损害肌肉再生和修复机制。结合监测和缓解肌肉健康的策略(例如阻力训练和营养干预)以及 SGLT2 抑制剂治疗,可以改善患者的预后。总之,糖尿病中线粒体功能障碍的影响(从视网膜病变和大血管并发症到治疗相关的挑战)对于推进患者护理至关重要。通过探索线粒体健康、氧化应激和代谢调节的相互关联的途径,将为制定有针对性的治疗策略和改善糖尿病管理的临床结果提供全面的框架。
3.3. 与糖尿病相关的线粒体DNA变异的表达糖尿病基因解码与糖尿病相关的线粒体 DNA (mtDNA) 变异的表达糖尿病基因解码为其对细胞功能的影响提供了宝贵的见解。以下糖尿病基因解码强调了了解糖尿病和相关并发症中 mtDNA 变异的表达模式的重要性。Inshah Din 等人的糖尿病基因解码调查了UCP2基因多态性 (-866 G/A) 及其表达与北印度人群糖尿病易感性之间的关联。UCP2 是一种线粒体解偶联蛋白,参与调节代谢途径,与 BMI 和高胰岛素血症有关。糖尿病基因解码发现,UCP2基因多态性的 -866 G/A 变异等位基因 (-866 G/A) 与 T2DM 显着相关,AA 基因型显示患糖尿病的风险增加 3.45 倍。与对照组相比,糖尿病患者的UCP2基因表达降低了 4.2 倍,表明 UCP2 在 T2DM 发病机制中发挥作用。年龄较大和BMI较高与UCP2表达进一步下降和2型糖尿病风险增加相关。糖尿病基因解码表明,UCP2基因表达和−866 G/A SNP可能在2型糖尿病的发展和进展中发挥重要作用。Medini等人对人类和小鼠胰腺α和β细胞中线粒体基因表达的糖尿病基因解码发现了两种不同的人类β细胞群。这些细胞群的线粒体RNA变体库和选择性特征存在差异,表明存在两个以前未被发现的β细胞群。相反,人类α细胞的线粒体基因表达并未表现出一致的分歧。这些糖尿病基因解码结果表明胰腺β细胞的线粒体基因表达表现出异质性,这可能影响其代谢和调节功能。需要进一步糖尿病基因解码这些发现是否适用于 2 型糖尿病等疾病,并确定其他细胞类型和组织中是否存在类似的线粒体异质性。Rong 等人开发了一种快速 TaqMan-MGB 定量实时 PCR 法,用于检测和量化线粒体 DNA 中的 mt.3243 A > G 变异,该变异是 MDD 和线粒体脑肌病等疾病的一个因素。该方法灵敏度高、定量可靠,与其他检测方法相关性好。尿沉渣、白细胞或毛囊可能是检测和量化该变异的理想模板。该方法为检测线粒体变异提供了一种快速、准确且经济有效的方法 。Kazuo Tomita等人开发了一种灵敏的方法,使用双TaqMan探针和qPCR检测线粒体DNA中的变异频率。该方法旨在检测与MELAS综合征相关的A3243G变异。该方法使用FAM和VIC探针准确计算了变异频率。与现有方法相比,角度法提高了变异频率测定的准确性。该方法也可以应用于其他疾病,例如糖尿病,表明其在糖尿病基因解码与糖尿病相关的线粒体变异方面具有潜力。
3.4. 利用细胞培养模型糖尿病基因解码线粒体DNA变异了解线粒体DNA变异所导致的细胞和分子改变对于开发有效的治疗方法至关重要。糖尿病基因解码调查了m.3243 A > G变异,该变异通常与MIDD和线粒体脑病、乳酸性酸中毒和中风样发作(MELAS)有关。这些糖尿病基因解码使用了不同的方法,例如检查尿液来源的干细胞(USC)和皮肤来源的成纤维细胞,以阐明该变异的影响和潜在的治疗靶点。这些发现为线粒体疾病的病理学提供了宝贵的见解,并强调了线粒体功能在糖尿病和相关疾病中的重要性。列出了一些糖尿病基因解码来展示mtDNA变异在不同细胞培养模型中的影响,如表3所示。
表 3.细胞培养糖尿病基因解码将线粒体DNA变异与糖尿病联系起来。基因解码变体细胞模型功能影响高等人m.3243A > G尿液干细胞 (USC)与骨矿化缺陷有关,具有自体细胞替代疗法的潜力,确定 ATF5 为潜在治疗靶点Mullin 等人m.3243A > G皮肤来源的真皮成纤维细胞成纤维细胞中 % m.3243G 与血液呈正相关,与 mtDNA 拷贝数呈负相关,% m.3243G 与视觉症状发作年龄呈负相关Chae 等人m.3243A > G患者案例由于多器官功能减退、药物异常反应和围手术期死亡等并发症风险较高,手术管理面临挑战Colclough 等人不适用骨髓间充质干细胞/基质细胞(BM-MSC)对 2 型糖尿病患者安全且耐受性良好,在 2 型糖尿病病程 <10 年且 BMI <23 的患者中观察到短期治疗效果,2 型糖尿病病程改变了 BM-MSCs 的增殖率,损害了糖酵解和线粒体呼吸,诱导了线粒体 DNA 变异积累Jiang 等多种线粒体DNA变体诱导性多能干细胞 (iPSC)2 型糖尿病 iPSC 中同质变异水平较高、耗氧率较低、胰岛素生成减少以及对葡萄糖反应的胰岛素分泌减少,mtDNA 变异导致胰腺细胞线粒体功能障碍Shand 等人多种线粒体DNA变体诱导性多能干细胞 (iPSC)T2DM iPSC 中同质变异水平较高、耗氧率较低、胰岛素生成减少以及对葡萄糖反应的胰岛素分泌减少,强调了在用于疾病建模或糖尿病自体细胞治疗之前筛查 mtDNA 变异的重要性张等人不适用血管平滑肌细胞(VSMC)硫化氢(H2S)可抑制高血糖和高脂血症时的血管平滑肌细胞(VSMC)增殖,机制涉及线粒体丙酮酸脱氢酶复合物-E1(PDC-E1),外源性H2S通过S-巯基化抑制PDC-E1易位,从而减少VSMC增殖Cömert 等人阴性 HSP60 突变体HEK293 细胞氧化应激和线粒体功能障碍导致神经退行性疾病、癌症、糖尿病和代谢综合征Jennings 等人DNAJC3 隐性变异患者成纤维细胞脂质代谢、线粒体生物能量学、内质网-高尔基体功能和淀粉样β蛋白加工的失调,表明线粒体功能障碍与糖尿病之间存在联系3.5. 线粒体DNA与糖尿病关系的新一代测序糖尿病基因解码下一代测序 (NGS) 彻底改变了糖尿病及其并发症中线粒体 DNA (mtDNA) 变异的糖尿病基因解码。以下糖尿病基因解码表明 NGS 在了解 mtDNA 变异在糖尿病和相关疾病中的作用方面的重要性。Materiah Salem Alwehaidah 等人的糖尿病基因解码已在患有银屑病 (Ps)、2 型糖尿病和 Ps-T2D 的科威特受试者中发现了线粒体 DNA (mtDNA) 变异中的新型非同义和同义变异。这些变异主要存在于编码复合物 I、III 和 V 亚基的基因中。患者组导致必需的线粒体酶复合物和 RNA 成分发生变化。大多数变异是同质的,还发现了一些同义变异。该糖尿病基因解码表明,mtDNA 变异可能导致 Ps、T2D 和 Ps-T2D 的发病机制,强调需要进一步进行功能分析以了解它们在这些疾病中的作用。
Hyun-Wook Chae 等人的糖尿病基因解码调查了儿童和青少年中线粒体肌病、脑病、乳酸性酸中毒和中风样发作 (MELAS) 综合征与糖尿病之间的联系。糖尿病基因解码人员使用新一代测序技术分析了 32 名被诊断为 MELAS 综合征的个体的线粒体 DNA (mtDNA) 以及 3243 核苷酸处的 mtDNA A 到 G 的转变。糖尿病基因解码发现变异负荷与 MELAS 综合征症状的发作、诊断年龄和糖尿病的存在呈负相关。此外,低变异负荷组和高变异负荷组的胰岛素抵抗或敏感性指数没有显著差异。在 3.7 年的随访期内,胰岛素抵抗指数保持稳定,基线和随访之间没有显著差异。综上所述,该糖尿病基因解码表明 MELAS 综合征的变异负荷与症状和相关疾病(如线粒体糖尿病)的出现有关,但似乎并不影响疾病的进展。糖尿病基因解码结果表明,MELAS 综合征的变异负荷可能在儿童和青少年患上这些疾病的过程中发挥作用。 Kevin Colclough 等人的糖尿病基因解码通过下一代测序(NGS)评估了对疑似年轻成年型糖尿病 (MODY) 患者的综合征性糖尿病基因常规检测。糖尿病基因解码发现,五分之一的疑似 MODY 患者携带综合征性糖尿病基因变异,尽管缺乏典型特征。该糖尿病基因解码强调了扩大检测范围以包括综合征基因的重要性,因为糖尿病特征与 MODY 重叠往往会导致转诊进行基因检测。综合征性糖尿病基因变异占所有单基因糖尿病病例的 19%,其中最常见的是线粒体 m.3243 A > G 变异和 HNF1B 变异。该糖尿病基因解码建议对疑似 MODY 且未表现出典型遗传综合征特征的患者进行综合征性单基因糖尿病基因(尤其是 m.3243 A > G 和 HNF1B)的常规检测。
Jiang 等人的糖尿病基因解码调查了 m.3243 A > G 变异在 母系遗传的糖尿病和耳聋 (MIDD)综合征家系中的遗传模式。他们发现该变异在一个家族中从头发生,表明它可以在没有母系遗传的情况下发生。先证者和她的儿子都患有糖尿病、轻度双侧听力丧失、脑部 MRI 异常和线粒体功能受损。全线粒体 DNA 测序显示 m.16093 T > C 处存在额外的异质体置换,这在 母系遗传的糖尿病和耳聋 (MIDD)或相关综合征中尚未见报道。
Shand 等人的糖尿病基因解码检查了线粒体DNA变异mt.3243 A>G,该变异与母系遗传的糖尿病和耳聋有关。糖尿病基因解码人员发现,携带该变异的同卵双胞胎会患上终末期肾病(ESRD)。双胞胎的异质体负荷更高,比她的姐姐早 15 年患上 ESRD。这表明,在患有 mt.3243 A>G 相关肾病的患者中,异质体水平与患 ESRD 的年龄之间存在相关性。该糖尿病基因解码还观察了双胞胎中 mt.3243 A>G 变异相关肾病的进展,这表明肾脏组织异质体所反映的外周血 mt.3243 A>G 异质体水平可能解释了疾病进展的差异。这些发现可能对理解这些疾病的发病机制和开发针对性疗法具有重要意义。
Yagi 等人的糖尿病基因解码检查了线粒体 DNA m.3243 A > G 变异与糖尿病等多器官疾病之间的联系。线粒体 DNA m.3243 A > G 变异可导致线粒体脑病、乳酸性酸中毒和中风样发作 (MELAS)。糖尿病基因解码人员利用尸检对象的遗传和病理检查来了解变异的器官异质体与临床表型之间的关系,特别是观察死亡年龄。他们发现,在脑、心肌和内分泌腺等非再生器官中发现了 m.3243 A > G 变异的高异质体水平,而在骨髓、脾脏和外周白细胞等再生器官中发现了低水平。尽管肝脏是再生器官,但发现其异质体水平很高。糖尿病基因解码还发现,MELAS 相关症状的发病年龄是导致死亡年龄偏低的重要原因,器官异质体水平越高,死亡年龄越低。这表明,异质体程度(尤其是肝脏中的异质体程度)是决定 m.3243 A > G 变异携带者死亡年龄的关键因素。Eirini Kaisari 等人的糖尿病基因解码调查了线粒体DNA A3243G点变异与糖尿病相关并发症(特别是女性患者的视网膜病变)之间的联系。A3243G变异与多种疾病有关,包括 MELAS、MID 和 CPEO。该糖尿病基因解码涉及六名患有该变异的 37 至 70 岁女性患者,她们表现出黄斑病变。黄斑病变与年龄无关,进展缓慢。糖尿病基因解码得出结论,A3243G变异可导致多种临床表现,包括黄斑病变,黄斑病变可影响中枢视觉功能,从无症状到法定失明。糖尿病基因解码结果应促使眼科医生了解患者的个人和家族病史,包括糖尿病和耳聋。
Marco-Campmany 等人的糖尿病基因解码展示了一例患有 母系遗传的糖尿病和耳聋 (MIDD)的病例,患者是一名 49 岁的男性,患有线粒体变异。患者在首次出现黄斑营养不良 20 年后出现黄斑囊肿。玻璃体内注射贝伐单抗治疗消除了囊性变化并恢复了视力。该糖尿病基因解码强调了诊断 母系遗传的糖尿病和耳聋 (MIDD)对预防黄斑营养不良和囊肿等并发症的重要性。需要进一步糖尿病基因解码以了解这种并发症的发病机制和治疗。印度东北部的一项糖尿病基因解码调查了线粒体DNA变异在一个特定民族部落中 2 型糖尿病发展中的作用。对糖尿病患者的线粒体基因组进行测序,确定了线粒体DNA变异及其与家族性 2 型糖尿病的关联。他们发现某些线粒体DNA变异,例如ND3基因中的8584 G > A和10398 A > G,与2型糖尿病风险显著相关。在位置12,417处观察到一种新的移码置换ND5: 81_81ins A,发现它是糖尿病的可能靶点,并为线粒体变异在米佐人群2型糖尿病易感性中的作用提供了有价值的见解。Barbara Lombardo等人对两兄弟进行了糖尿病基因解码,他们患有一种多系统疾病,即包括糖尿病的Alstrom综合征,通过全外显子组测序对线粒体DNA测序找到了明确的诊断。ALMS1基因中的变异会影响细胞内运输、纤毛功能和胰岛素受体运输,它导致蛋白质水平的移码和终止密码子的提前出现。这凸显了基因组分析在诊断罕见复杂疾病中的重要性,以及 WES 在提供明确诊断和指导个性化治疗中的作用。Ohwada 等人的糖尿病基因解码发现,一名患有线粒体疾病和糖尿病的患者在接受胰岛素输注治疗期间,血乳酸水平出现短暂性升高。这种升高不是由于心力衰竭或肾功能恶化,而是由于线粒体功能障碍的胰岛素敏感组织中的糖酵解增强,以及骨骼肌和衰竭心脏中的乳酸消耗减少。该糖尿病基因解码表明,组织缺氧或糖酵解与线粒体氧化脱钩等因素,即使在有氧条件下也会导致乳酸生成增加。
 云霞育儿网
云霞育儿网
发表评论:
◎欢迎参与讨论,请在这里发表您的看法、交流您的观点。