质粒 DNA 转染是分子生物学领域探究基因功能、调控基因表达的核心技术,在基础科研与临床前研究中占据不可或缺的地位。但巨噬细胞、神经细胞、肿瘤细胞等特殊细胞类型,因自身结构与生理特性的特殊性,常面临转染效率低下、细胞毒性过强等棘手问题,成为制约相关研究深入推进的关键障碍。破解难转染细胞的转染难题,需从其转染障碍机制入手,剖析传统转染技术的局限,进而探索更高效低毒的新型转染方案。本文将聚焦难转染细胞的转染特性,深入解读传统试剂的应用短板,并重点推介基于可降解生物纳米材料的新型转染试剂,为相关领域研究提供技术参考。
一、巨噬细胞、神经细胞、肿瘤细胞的转染屏障机制深度剖析
难转染细胞对常规转染技术的抵抗性,源于多重相互关联的细胞固有屏障,从细胞膜到细胞内环境形成了层层阻碍。
细胞膜的特殊结构与特性构成了外源质粒 DNA 进入细胞的第一道物理防线。巨噬细胞作为天然免疫哨兵,细胞膜表面密布免疫识别受体,膜流动性差,对外源物质具有极强的识别与排斥能力;其活跃的内吞系统还会将进入细胞的质粒DNA -载体复合物快速捕获并降解,阻碍其有效逃逸。神经细胞(如SH-SY5Y)具有典型的神经元形态,细胞膜上神经递质受体与离子通道密集,细胞间的紧密连接进一步限制了转染复合物的吸附与内化,加之其缓慢的增殖速率,使得依赖细胞分裂实现的外源基因核内整合难以顺利进行。肿瘤细胞的细胞膜特性更为复杂,不同类型肿瘤细胞的膜成分差异显著,部分肿瘤细胞高表达ABC转运蛋白等外排泵,可主动将进入胞内的转染复合物排出,形成天然的抗转染屏障。
细胞内源性防御机制与代谢特性进一步加剧了转染难度。巨噬细胞对外源核酸高度敏感,会将质粒 DNA 识别为“外来入侵者”,触发强烈的先天性免疫反应,既导致细胞存活率下降,又通过干扰素反应抑制外源基因表达。神经细胞与原代肿瘤细胞代谢活性较低,胞内物质转运与信号传导效率弱,转染复合物进入后难以高效完成内体逃逸、核转运等关键步骤;同时,这类细胞内源性核酸酶活性较高,易降解未被有效保护的质粒 DNA,进一步降低转染效率。此外,部分肿瘤细胞与原代细胞增殖能力微弱甚至停滞,而传统转染试剂的转染效率与细胞周期密切相关,静止期细胞的核膜屏障难以突破,导致外源基因无法有效进入细胞核进行转录与表达。
转染过程本身作为外部刺激,还易触发难转染细胞的强烈应激或凋亡通路,尤其是使用具有潜在细胞毒性的转染试剂时,会导致细胞存活率与转染效率双双下降。这些多重生物物理与生物化学屏障的共同作用,使得难转染细胞的高效低毒转染成为长期困扰研究者的技术难题。
二、传统转染试剂在巨噬细胞、神经细胞、肿瘤细胞中的应用局限
目前商业化转染试剂多以阳离子脂质体(如 Lipofectamine 3000)或聚乙烯亚胺(PEI)为核心成分,其转染机制是通过阳离子基团与带负电的质粒DNA形成静电复合物,借助阳离子与细胞膜负电位的相互作用实现吸附、内吞,再通过“质子海绵效应”完成内体逃逸并释放质粒 DNA。这类试剂在HEK293、HeLa等普通贴壁细胞中已实现较高的转染效率,成为常规实验的首选,但应用于 RAW264.7、SH-SY5Y等难转染细胞时,却暴露出明显短板,难以满足实验需求。
转染效率不足是传统试剂的核心问题。在 RAW264.7 巨噬细胞转染中,阳离子脂质体或PEI形成的复合物易被免疫识别系统捕获并吞噬降解,内体逃逸效率极低,且试剂的阳离子特性会激活巨噬细胞免疫应答,进一步抑制外源基因表达,转染阳性率通常低于20%;SH-SY5Y等神经细胞因膜结构特殊、内体屏障难以突破,转染效率仅维持在10%-30%;肿瘤细胞则因高表达外排泵及膜特性异质性,导致传统试剂形成的复合物难以在胞内稳定存在,转染效率波动大,无法实现规模化高效转染。
显著的细胞毒性进一步限制了传统试剂的应用范围。阳离子脂质体的强阳性电荷易破坏细胞膜完整性,导致细胞通透性异常,引发凋亡或坏死;PEI 因不可降解特性,进入细胞后易蓄积,加重细胞代谢负担,诱发活性氧累积与炎症反应,对脆弱的难转染细胞造成严重损伤。在原代肿瘤细胞或神经细胞转染中,Lipofectamine 3000与PEI常导致超过30%的细胞死亡。此外,传统阳离子试剂多要求在无血清条件下转染,且需在转染后4-6小时更换培养液,不仅增加了实验流程的复杂性,无血清环境还会加剧难转染细胞的应激反应,进一步降低细胞存活率。
三、新型可降解生物纳米材料转染试剂的技术突破与应用优势
针对传统阳离子转染试剂的应用瓶颈,基于可降解生物纳米材料研发的 Lipofect5000 质粒转染试剂,通过材料创新与机制优化,实现了转染效率与细胞毒性的协同提升,为巨噬细胞、神经细胞、肿瘤细胞等难转染细胞的质粒DNA转染提供了理想解决方案,其核心优势相较于Lipofectamine 3000等传统试剂更为突出。
转染效率大幅提升,全面超越传统主流试剂。Lipofect5000 采用新型可降解生物纳米材料作为载体,通过精准调控纳米颗粒的尺寸与表面电荷,既增强了与质粒DNA的结合稳定性,又提升了与难转染细胞细胞膜的亲和性,促进转染复合物的特异性内化。
(1)在 RAW264.7 巨噬细胞转染实验中,其转染阳性率高达60%以上,显著优于传统试剂;

(2)针对 SH-SY5Y 神经细胞,转染阳性率可超过50%,远超传统阳离子试剂10%-20%的效率水平;

(3)在结肠癌细胞 HCT116 等多种肿瘤细胞中,该试剂能有效规避外排泵作用,实现稳定高效转染,转染效率达90%以上,较Lipofectamine 3000提升50%以上。
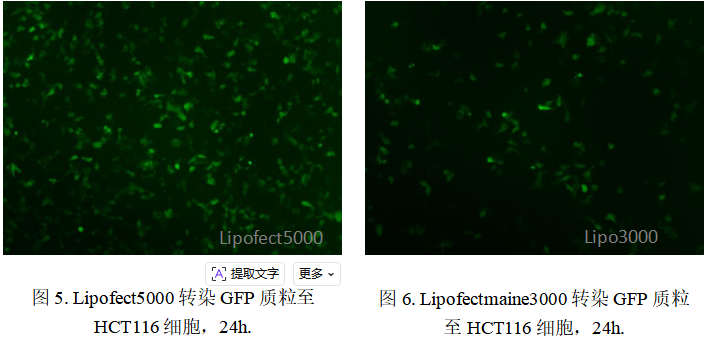
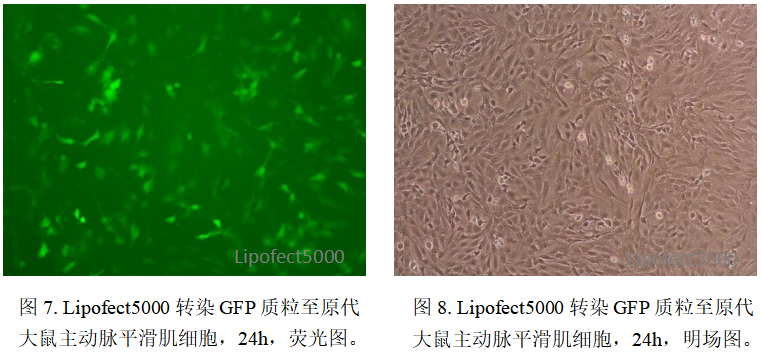
细胞毒性极低,保障转染细胞生理功能完整。Lipofect5000 的核心创新在于采用可降解生物纳米材料,这类材料进入细胞后可在胞内环境中快速降解为无毒或低毒的代谢产物,避免了传统试剂的蓄积毒性,转染后细胞死亡率仅为10%左右,与空白对照组无显著差异。这一低毒性优势使其成功应用于对转染试剂极为敏感的原代细胞,例如在原代大鼠主动脉平滑肌细胞转染实验中,既能实现80%以上的转染阳性率,又能维持细胞正常生理状态,破解了传统试剂在原代细胞转染中效率与毒性难以平衡的难题。
操作简便且血清兼容性强,实验实用性更高。Lipofect5000 配备专用Trans Buffer,可完全替代无血清培养基,在含血清条件下仍能维持稳定转染效率,无需进行无血清孵育与转染后换液操作,显著简化了实验流程,同时避免了无血清环境对难转染细胞的应激损伤,进一步保障细胞活性。此外,与国际权威品牌相比,Lipofect5000在转染性能显著优于部分传统试剂的同时,价格仅为其30%左右,具备极高的性价比,更适合大规模难转染细胞转染实验的应用需求。