在对抗癌症的免疫战场上,T细胞本是冲锋在前的“精锐部队”。但很多时候,这些战士会陷入“疲惫不堪”的状态——医学上称为“T细胞耗竭”,这也是很多癌症免疫治疗效果不佳的关键原因。
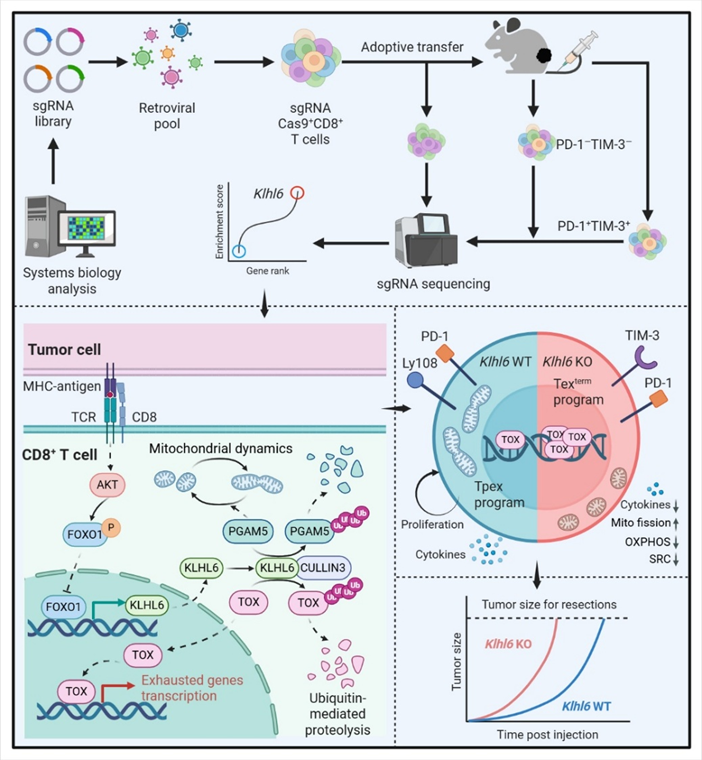
近期,中国医学科学院系统所李贵登团队与FredHutchinson癌症研究中心的PhilipD.Greenberg团队合作,在Nature和Immunity&Inflammation上同步发表题为“TheUbiquitinLigaseKLHL6DrivesResistancetoCD8+TCellDysfunction”和“ChronicTCRSignaling-DrivenSuppressionoftheFOXO1-KLHL6AxisPromotesTCellExhaustion”的两篇研究论文发现了一个能唤醒疲惫T细胞的“关键开关”——KLHL6蛋白,为癌症治疗开辟了全新思路。


一、KLHL6:T细胞的“抗疲劳指挥官”
研究团队通过一系列实验发现,KLHL6蛋白就像T细胞的“专属指挥官”,主要通过两种方式保持部队战斗力:
一方面,它能清除T细胞里的“疲劳信号”TOX蛋白。TOX是导致T细胞耗竭的“罪魁祸首”,KLHL6会给TOX蛋白打上“降解标签”,让细胞内的“垃圾处理系统”(蛋白酶体)将其清除,从而延缓T细胞从“潜力士兵”(前体耗竭T细胞)向“彻底躺平”(终末耗竭T细胞)转变。
另一方面,它能守护T细胞的“能量工厂”线粒体。线粒体就像T细胞的“发动机”,持续战斗会让发动机过度“磨损”(线粒体分裂异常)。KLHL6通过调控PGAM5-Drp1信号轴,防止线粒体过度分裂,保证能量供应,让T细胞有足够体力持续对抗肿瘤。
但可惜的是,肿瘤微环境会通过持续刺激T细胞,让KLHL6的表达量大幅下降。没了这位指挥官,T细胞很快就会陷入耗竭,失去战斗能力。
二、实验实证:KLHL6让T细胞“满血复活”
在动物实验中,KLHL6展现出了强大的“赋能”效果:
研究人员给黑色素瘤小鼠体内的T细胞增强KLHL6表达后,这些T细胞像开了“外挂”——耗竭标志物(PD-1、TIM-3)显著减少,分泌的抗癌细胞因子(IFN-γ、TNF-α)大幅增加,肿瘤生长被有效抑制,小鼠的生存期明显延长。
在慢性病毒感染模型中,增强KLHL6表达的T细胞也表现出色,不仅能有效抑制病毒复制,还能长期保持自身活力,不会轻易“累倒”。更重要的是,人类T细胞中增强KLHL6表达后,也呈现出同样的“战斗力提升”效果,这意味着该发现能快速向临床转化。
反之,如果敲除KLHL6基因,T细胞会快速耗竭,线粒体功能严重受损,对抗肿瘤和病毒的能力大幅下降,充分证明了KLHL6是维持T细胞功能的核心。
三、背后机制:FOXO1是KLHL6的“上游开关”
研究还揭开了KLHL6的调控机制:转录因子FOXO1是KLHL6的“开关”,能直接结合KLHL6的启动子区域,促进其表达。但持续的肿瘤刺激会激活PI3K-AKT信号通路,让FOXO1失去活性,无法启动KLHL6的转录。
当研究人员使用AKT抑制剂阻断这一通路时,FOXO1恢复活性,KLHL6表达回升,T细胞耗竭得到明显缓解。这一发现意味着,未来可以通过激活FOXO1或抑制PI3K-AKT通路,间接增强KLHL6的功能,为开发靶向药物提供了更多思路。
四、临床前景:为癌症治疗带来双重突破
KLHL6的发现让癌症免疫治疗有了新方向,相比传统治疗,它有两大独特优势:
一是“双管齐下”:既直接逆转T细胞耗竭,又修复线粒体功能,从“指挥系统”和“能量供应”两方面提升T细胞战斗力,效果更全面。
二是“跨界作战”:KLHL6不仅能激活免疫细胞,还能直接抑制肿瘤细胞增殖。它能促进CDK2、NOTCH2等肿瘤促进因子的降解,相当于同时攻击肿瘤细胞和激活免疫系统,实现“双重打击”。
小编觉得这篇文章指明了这个靶点两个非常明确的药物研发方向:
方向一:直接激活KLHL6功能制药界可以瞄准它开发KLHL6激动剂,或者利用前沿的PROTAC技术精准激活其功能。它能“双管齐下”:一边清除导致T细胞疲劳的“罪魁祸首”TOX蛋白,一边修复为T细胞供能的线粒体。这种同时解决“指挥系统”和“能量供应”的策略,有望让免疫细胞的战斗力获得质的飞跃。更妙的是,KLHL6在人类T细胞中的功能是保守的,这意味着临床转化的门槛大大降低。
方向二:赋能现有尖端疗法KLHL6的潜力不止于单独用药。它极有可能成为下一代细胞免疫疗法(如CAR-T、TCR-T)的“超级增强组件”。通过基因工程,让这些“定制化免疫战士”高表达KLHL6,它们就能更持久、更耐耗竭地在肿瘤微环境中作战。这对于一直难以攻克的实体瘤而言,可能是一个关键的突破口。
参考文献:
ChengH,SuY,PanX,XuY,XieE,DuJ,ChenDG,DaiX,GottardoR,GreenbergPD,LiG.TheubiquitinligaseKLHL6drivesresistancetoCD8+Tcelldysfunction.Nature.2026Jan14
PanX,PanY,SuY,XuY,DuJ,ChengH,LiG.ChronicTCRsignaling-drivensuppressionoftheFOXO1-KLHL6axispromotesTcellexhaustion.ImmunInflamm.2026;2(1):8.