转自:药明康德
编者按:第85届美国糖尿病协会(ADA)科学年会已经在美国芝加哥落下帷幕。ADA年会是全球规模最大的糖尿病和代谢疾病学术会议之一,本届年会上,多家生物医药公司汇报了基于胰高血糖素样肽-1(GLP-1)信号通路开发的创新疗法的最新临床试验结果。GLP-1药物是治疗糖尿病和肥胖症的研发热点之一,目前全球已有超过80款相关药物或药物组合进入临床开发阶段,其中多肽疗法仍是主流。在GLP-1药物开发热潮到来之前,药明康德旗下的WuXiTIDES早已围绕多肽药物建立了一体化CRDMO平台,提供所有类型的多肽,包括线性、环状和高度修饰的多肽,以及非天然氨基酸、连接子、毒素和多肽偶联药物的合成服务,支持从药物发现、CMC开发到商业化生产的各个阶段,助力合作伙伴更高效地为患者提供新一代GLP-1疗法。本文将与读者分享在ADA年会上公布的GLP-1药物的最新研发进展。
减掉的超过90%是脂肪!组合疗法2期临床结果公布
研究人员公布了礼来公司(EliLillyandCompany)开发的在研疗法bimagrumab与诺和诺德公司(NovoNordisk)的GLP-1药物Wegovy(司美格鲁肽)联用,治疗肥胖症的2b期临床试验BELIEVE的最新结果。Bimagrumab是一款潜在“first-in-class"的单克隆抗体,靶向激活素2型受体(ActRII)。ActRII是在脂肪和肌肉细胞中都表达的激活素受体。ActRII受体激活可引发肌肉萎缩并促进脂肪组织中脂肪的堆积。通过阻断该通路,有望在减少脂肪的同时,改善患者的肌肉组成。
试验数据显示,接受bimagrumab/Wegovy组合疗法治疗的受试者在72周后体重平均降低22.1%。值得注意的是,丢失的体重中92.8%源于脂肪组织减少。与单药治疗相比,该组合在减少腹部脂肪和炎症相关生物标志物方面也显示出更显著的疗效。
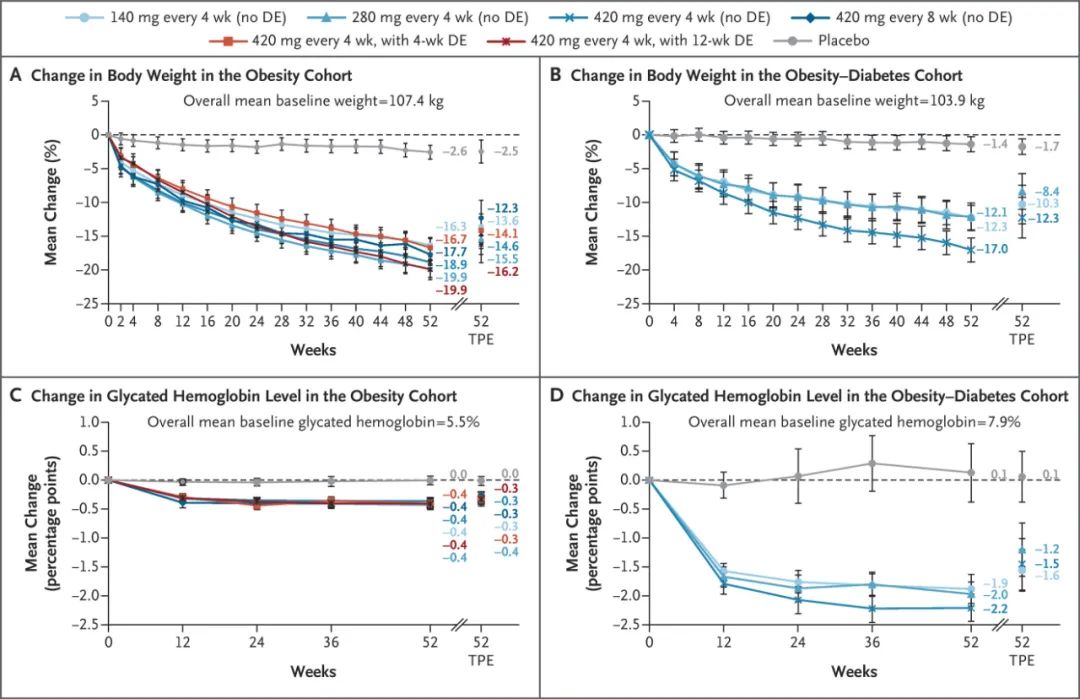
体重减轻约20%,安进MariTide完整2期结果发布
安进公司(Amgen)今日公布了其在研药物MariTide(maridebartcafraglutide,前称AMG133)2期临床试验第一部分的完整结果。MariTide是一款潜在“first-in-class”的在研抗体多肽偶联药物,在靶向胃抑制肽受体(GIPR)的单克隆抗体的特定位点上偶联了两个GLP-1类似物,在激活GLP-1受体的同时抑制GIPR。它可通过皮下注射每月或更低频率给药。相关研究结果同时发表于《新英格兰医学杂志》。
在2期研究中,MariTide在无2型糖尿病的肥胖人群中实现了最高约20%的平均体重减轻,而安慰剂组为2.6%;在患有糖尿病的肥胖人群中,MariTide组的体重平均减轻最高可达约17%,而安慰剂组仅为1.4%。在第52周时,体重减轻仍未出现平台期,显示出进一步减重的潜力。除了显著的减重效果外,MariTide还在患有糖尿病的肥胖人群中实现了最高达2.2个百分点的糖化血红蛋白(HbA1c)持续且显著下降。体重下降还伴随着一系列心血管代谢指标的改善,包括腰围、血压、高敏C反应蛋白(hs-CRP)及部分血脂参数的改善。
礼来口服GLP-1激动剂3期结果登《新英格兰医学杂志》
礼来公司公布了ACHIEVE-1研究的详细结果。这项3期临床试验评估了orforglipron在仅通过饮食和锻炼控制血糖仍不理想的2型糖尿病成人患者中的安全性与有效性。新闻稿指出,orforglipron是首款完成3期临床试验的口服小分子(非肽类)GLP-1受体激动剂,在服用过程中不受进食与饮水的限制。在第40周时,orforglipron的3种剂量(3mg、12mg、36mg)均达到主要终点,即在降低HbA1c方面优于安慰剂。此外,12mg和36mg剂量在体重减轻方面也表现出具有临床意义和统计学显著性的优势。研究显示,orforglipron的安全性特征与已有GLP-1药物相似,最常见的不良事件为胃肠道相关反应。相关结果已在ADA科学年会上公布,并同步发表于《新英格兰医学杂志》。

在研究中,orforglipron在第40周达到主要终点,与安慰剂相比,其HbA1c下降幅度为1.3至1.6个百分点。在关键性次要终点方面,最多达76.2%的orforglipron受试者实现了ADA设定的治疗目标HbA1c<7个百分点;66.0%的受试者达到HbA1c≤6.5个百分点;25.8%的受试者达到HbA1c<5.7个百分点,即正常HbA1c范围。在另一项关键性次要终点中,接受最高剂量orforglipron治疗的受试者平均减重16.0磅(7.9%)。更长期的研究(如ATTAIN研究)将进一步全面评估orforglipron在肥胖治疗中的安全性与疗效。
Orforglipron是一种每日一次的在研口服小分子GLP-1受体激动剂。它由ChugaiPharmaceutical发现,并于2018年授权给礼来公司。目前,礼来正开展orforglipron治疗2型糖尿病,以及治疗肥胖或超重成人患者的3期研究。
诺和诺德amycretin早期临床结果登《柳叶刀》,直接进入3期临床试验
诺和诺德公司宣布,在研创新肥胖治疗药物amycretin的两项早期临床试验结果在《柳叶刀》杂志上发布。Amycretin是诺和诺德正在研发的一种单分子长效GLP-1和胰淀素受体激动剂,拟用于治疗成人超重或肥胖人群,以及2型糖尿病患者。

皮下注射amycretin的1b/2a期试验结果显示,治疗伴发不良事件(TEAEs)多数为轻度或中度,其发生频率呈剂量依赖性升高。最常见的不良事件为胃肠道相关症状。与安慰剂相比,接受amycretin治疗的受试者在研究的所有剂量范围内均观察到更显著的体重下降。接受最高剂量(60mg)治疗的受试者在36周治疗后体重平均减轻幅度可达24.3%,而安慰剂组仅为1.1%。这一研究结果支持继续探索amycretin在减重方面的潜在疗效。
已发表的口服amycretin的1期研究结果显示,最常见的不良事件为胃肠道症状以及食欲下降,且在较高剂量组中更为常见。接受治疗的受试者在所有剂量组中均显示出明显优于安慰剂组的体重减轻效果。探索性分析显示,每日口服100mgamycretin的受试者在12周后平均体重减轻幅度为13.1%,而安慰剂组仅为1.2%。基于上述及其他已完成的临床研究结果,并结合监管机构的反馈意见,诺和诺德将推进口服与皮下注射两种剂型的amycretin进入3期临床开发,用于体重管理。
体重减轻超13%,先为达生物偏向性GLP-1类似物3期临床结果发布
先为达生物在ADA年会上发布了其在研cAMP偏向性GLP-1类似物埃诺格鲁肽(ecnoglutide)注射液的3期临床试验结果。该结果同时在TheLancetDiabetesandEndocrinology上发表。Ecnoglutide的cAMP偏向性可能通过降低GLP-1受体的内化和增强胰岛素的分泌来增强GLP-1受体激动剂的临床效果。

在2023年4月5日至2024年6月20日期间,这项3期临床试验中,664人被随机分配接受不同剂量的ecnoglutide或安慰剂治疗。在第40周,体重的最小二乘均值百分比变化分别为:ecnoglutide1.2毫克组为-9.1%,1.8毫克组为-10.9%,2.4毫克组为-13.2%,而安慰剂组为0.1%。与安慰剂相比,各剂量组的预估治疗差值分别为-9.2%、-11.1%和-13.3%,所有比较的p值均