转自:生物谷
在全球范围内,营养不良问题依旧严峻,尤其在发展中国家,严重营养不良影响着众多儿童的健康成长。患有严重营养不良的儿童,常出现肝功能障碍症状,比如低血糖、低白蛋白血症和肝脂肪变性,这背后与肝脏中过氧化物酶体和线粒体的变化密切相关。
近期,发表于BiochimBiophysActaMolBasisDis的一项研究Docosahexaenoicacidpreventsperoxisomalandmitochondrialproteinlossinamurinehepaticorganoidmodelofseveremalnutrition为改善这一状况带来了新希望。

过往研究发现,低蛋白饮食会致使啮齿动物肝脏中的过氧化物酶体减少和线粒体功能障碍,这在体外实验中也得到了验证,在低氨基酸环境下培养的肝类器官也出现了类似变化。不过,对于这两种细胞器减少背后的病理生理机制,人们了解得还十分有限。有研究表明,低氨基酸浓度下细胞器的降解可能与自噬增加有关,自噬在清除错误折叠的蛋白质和受损细胞器的同时,也能在营养缺乏时维持细胞内氨基酸水平,但过度自噬可能会影响脂质代谢。
在这项研究中,科研人员利用此前建立的小鼠肝类器官严重营养不良模型,深入探究了长时间氨基酸限制对过氧化物酶体和线粒体蛋白水平以及自噬通量的影响。他们通过多种实验方法,包括使用13C标记的肽标准串联体定量过氧化物酶体蛋白、用GFP-LC3-RFP-LC3ΔG探针评估自噬通量等,测试了不同PPAR-α激动剂对过氧化物酶体损失的作用。
研究结果显示,长时间(96小时)的氨基酸限制比48小时的限制,对过氧化物酶体标记蛋白水平的影响更为严重。免疫印迹分析表明,过氧化物酶体膜蛋白PMP70、过氧化物酶体β-氧化的关键酶酰基辅酶A氧化酶1(ACOX1)和过氧化氢酶的水平,在氨基酸限制96小时后显著降低。免疫荧光分析和电子显微镜观察发现,氨基酸限制96小时后,过氧化物酶体数量减少,细胞中出现了类似自噬体或自溶酶体的结构,这意味着自噬被诱导。同时,研究还发现氨基酸限制对过氧化物酶体生物发生相关基因的表达也有影响,不同的过氧化物酶相关基因表达呈现出不同的变化趋势。
进一步研究发现,氨基酸限制会激活自噬通量。通过基于GFP-LC3-RFP-LC3ΔG探针的系统检测,科研人员发现,随着氨基酸限制时间延长,自噬通量显著增加。而且,这种由氨基酸限制诱导的自噬,对传统的自噬抑制剂如巴弗洛霉素A1和氯喹并不敏感。
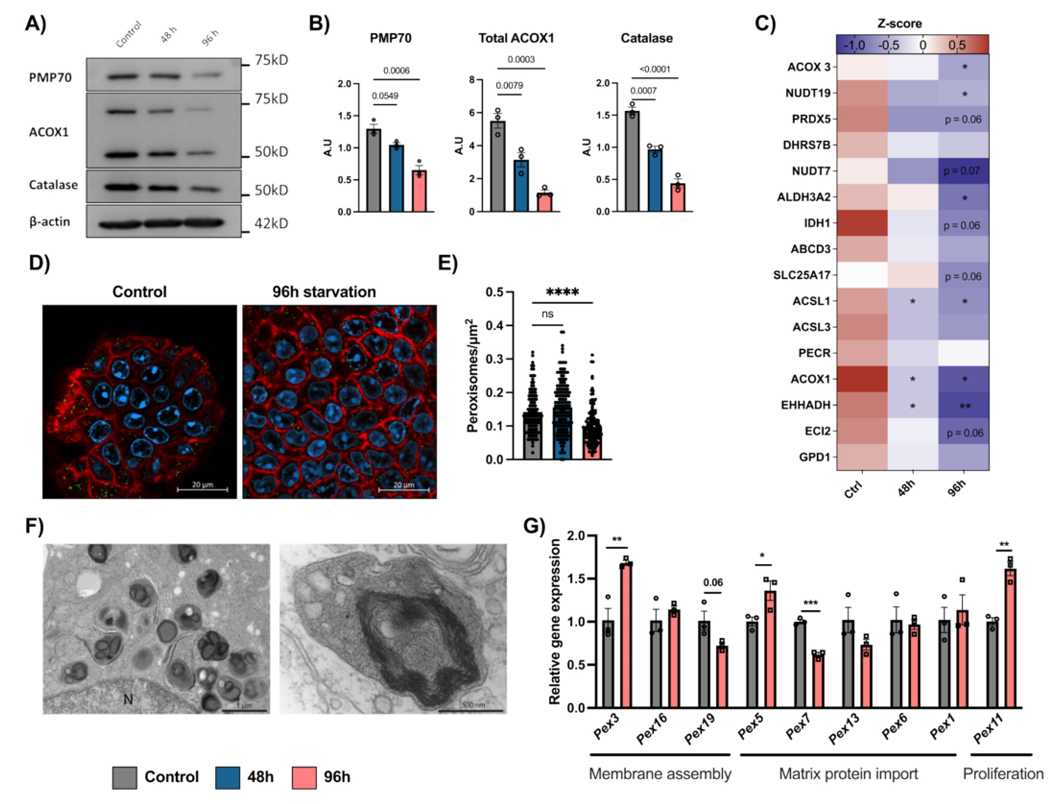
在测试PPAR-α激动剂对过氧化物酶体损失的预防作用时,研究人员发现,合成化合物WY-14643和亚油酸(LA)对过氧化物酶体蛋白标记物的恢复作用甚微,而二十二碳六烯酸(DHA)却能部分阻止过氧化物酶体和线粒体蛋白在氨基酸限制条件下的损失。定量靶向蛋白质组学分析表明,DHA能够防止过氧化物酶体和线粒体中参与脂肪酸β-氧化、三羧酸循环和氧化磷酸化的蛋白质减少。
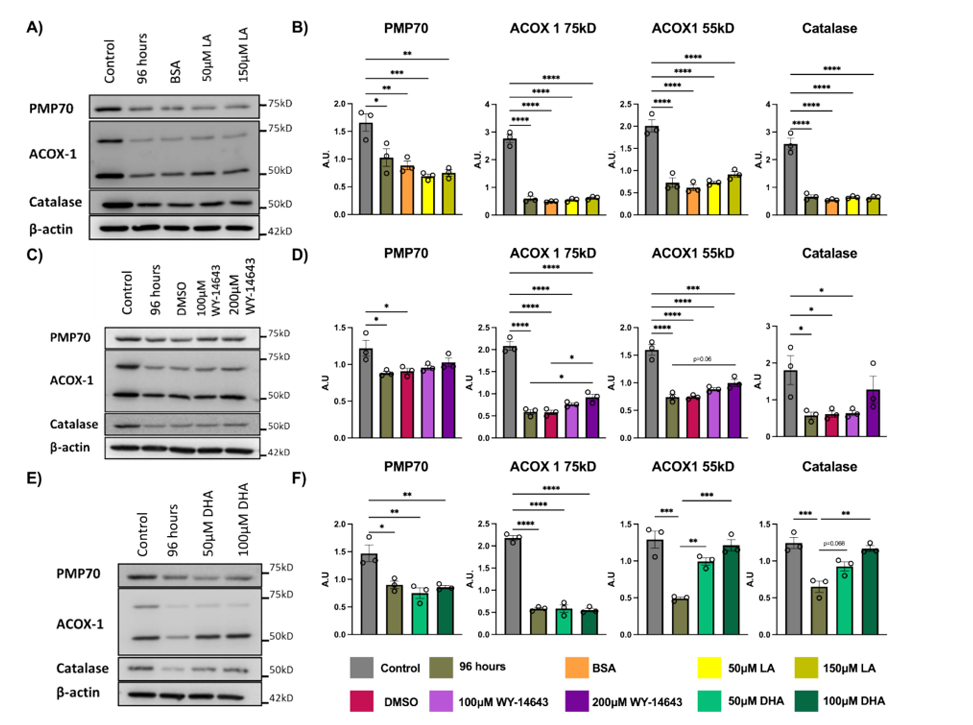
不过,DHA对细胞内甘油三酯(TG)水平的影响较为复杂。虽然理论上DHA可能降低TG水平,但实验中补充DHA后,肝类器官中的TG水平并未降低,高浓度的DHA甚至导致TG进一步积累,这可能与DHA参与磷脂合成或直接掺入TG有关。在过氧化物酶体功能方面,研究发现氨基酸限制会影响过氧化物酶体对植烷酰辅酶A的代谢,而DHA补充对此并无明显影响。
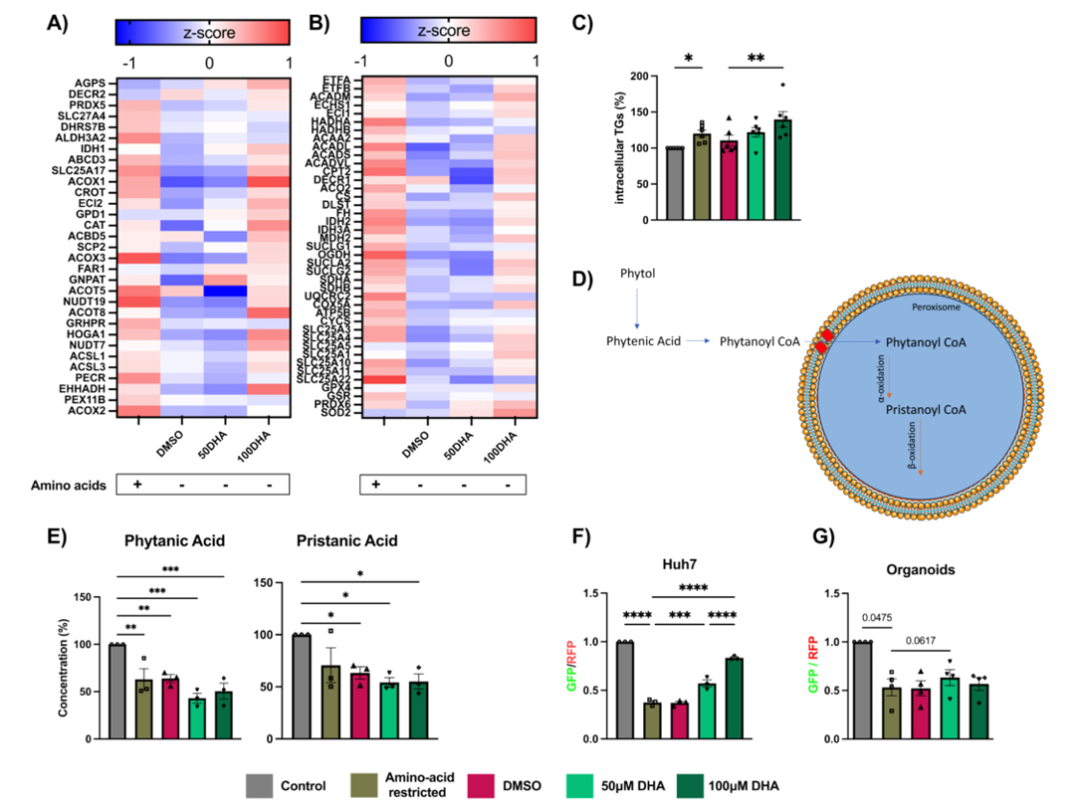
总的来说,这项研究证实了在小鼠肝类器官严重营养不良模型中,DHA能够防止部分过氧化物酶体和线粒体蛋白的损失。这一发现为改善严重营养不良患者的肝脏健康提供了新的潜在方向,DHA有望成为一种有效的营养补充剂。未来,还需要在更符合生理条件的动物模型以及临床试验中进一步验证DHA的效果,期待这一成果能早日应用于临床,为改善全球营养不良儿童的健康状况带来实质性的帮助。
参考文献:
Horcas-NietoJM,Rios-OcampoWA,Langelaar-MakkinjeM,etal.Docosahexaenoicacidpreventsperoxisomalandmitochondrialproteinlossinamurinehepaticorganoidmodelofseveremalnutrition.BiochimBiophysActaMolBasisDis.PublishedonlineApril29,2025.doi:10.1016/j.bbadis.2025.167849
(转自:生物谷)