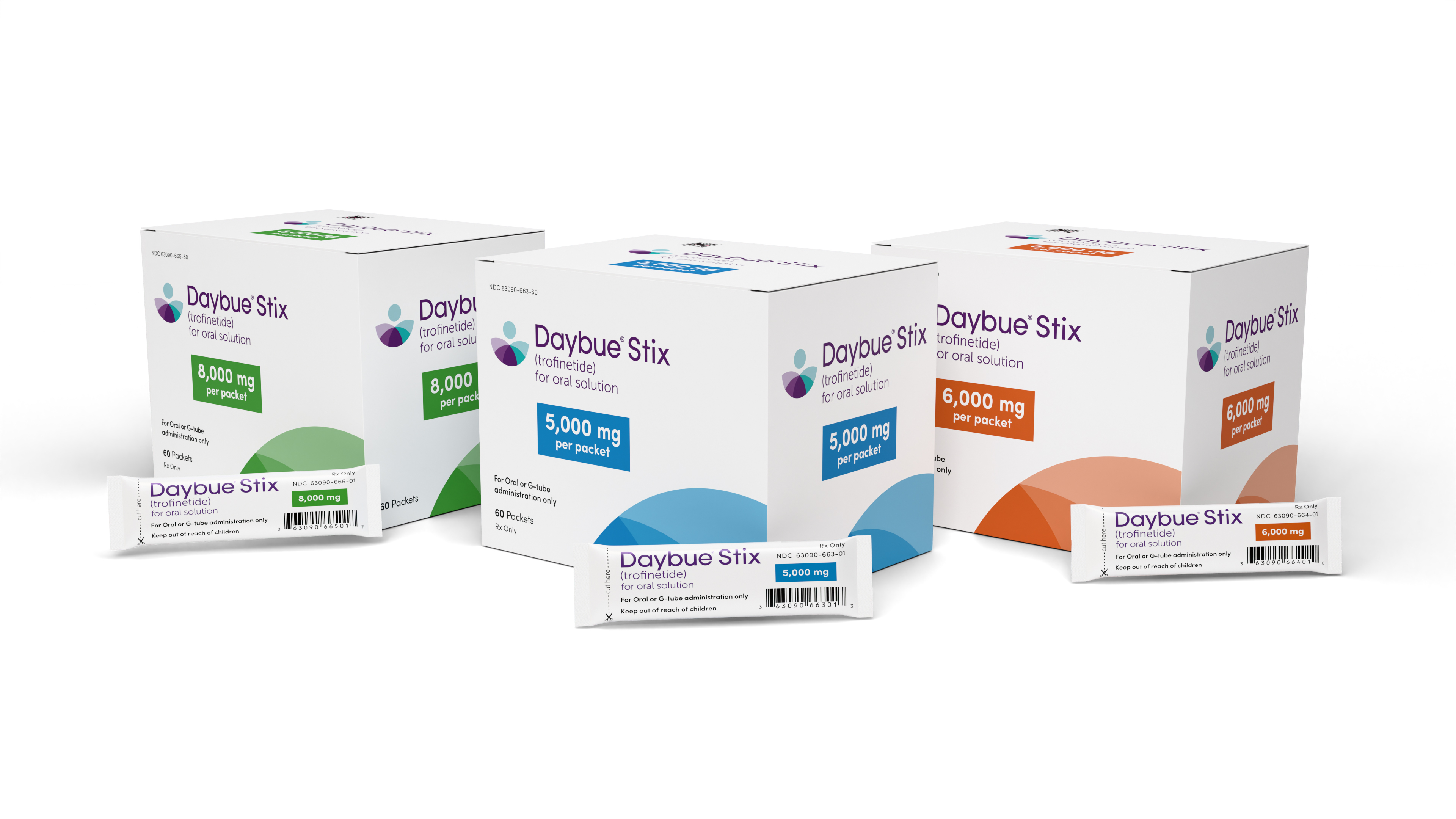
据Acadia制药公司宣布,美国FDA已批准口服溶液粉剂Daybue® Stix,用于治疗2岁及以上成人和儿科患者的雷特综合征。这是Daybue(Trofinetide)的新配方,有望为患者提供更大的灵活性,因为它可与多种水基液体混合,从而可以调整口味和剂量。而Daybue的口服溶液剂型也将继续供应。

Trofinetide是一种新型合成的甘氨酸-脯氨酸-谷氨酸类似物,是胰岛素样生长因子-1的氨基末端三肽。它最初于2023年获批用于治疗雷特综合征,获批依据是3期LAVENDER研究(NCT04181723)的数据。研究结果表明,根据雷特综合征行为问卷总分(P=0.018)和临床总体印象改善量表评分(P=0.003)与起始相比的变化,该治疗显著减轻了与雷特综合征相关的症状。
Daybue Stix的有效性是根据Daybue口服溶液的LAVENDER研究结果以及一项生物等效性研究的结果确定的,该研究表明两种制剂的药代动力学相似。
Daybue Stix口服溶液剂为草莓味粉末,不含色素和防腐剂,有5000毫克、6000毫克和8000毫克三种规格的独立包装。该公司预计将于2026年第一季度限量供应新配方,并于2026年第二季度扩大供应量。
1.警告和注意事项
腹泻:在一项为期12周的研究和长期研究中,85%的Daybue治疗患者出现腹泻。在接受Daybue治疗的患者中,49%的患者在停药、减量或同时使用止泻药后腹泻缓解,但仍持续存在或复发。96%的病例腹泻程度为轻度或中度。在为期12周的研究中,51%的Daybue治疗患者使用了止泻药。建议患者在开始使用Daybue或Daybue Stix前停用泻药。如果出现腹泻,患者应告知医护人员,考虑开始止泻治疗,并监测水合状态,必要时增加口服液体摄入量。如果出现严重腹泻或怀疑脱水,应暂停、减少剂量或停止使用Daybue或Daybue Stix。呕吐:在一项为期12周的研究中,接受Daybue治疗的患者中有29%出现呕吐,而接受安慰剂的患者中有12%出现呕吐。雷特综合征患者有发生误吸和吸入性肺炎的风险。已有报告称,接受Daybue治疗的患者在呕吐后出现误吸和吸入性肺炎。如果呕吐严重或经药物治疗后仍持续发生,应暂停使用、减少剂量或停止使用Daybue或Daybue Stix。
体重减轻:在为期12周的研究中,接受Daybue治疗的患者中有12%的体重较起始下降超过7%,而安慰剂组患者中仅有4%出现这种情况。在长期研究中,2.2%的患者因体重减轻而停止使用Daybue。监测体重,如果出现显著的体重减轻,应暂停、减少剂量或停止使用Daybue或Daybue Stix。
2.不良反应
在为期12周的研究中,报告的常见不良反应(Daybue治疗组发生率≥5%,且比安慰剂组至少高2%)包括腹泻、呕吐、发热、癫痫发作、焦虑、食欲下降、疲乏和鼻咽炎。3.药物相互作用
Daybue和Daybue Stix对其他药物的影响:Trofinetide是一种弱效的CYP3A抑制剂和P-gp抑制剂,可升高CYP3A和/或P-gp底物(例如洛哌丁胺)的血浆浓度,从而可能增加与这些底物相关的不良反应风险。当Daybue或Daybue Stix与对CYP3A和/或P-gp敏感的底物(即治疗指数窄的药物)同时使用时,应密切监测患者,因为即使是底物血浆浓度的轻微升高也可能导致严重不良反应。
4.特殊人群用药
肾功能不全:Daybue和Daybue Stix不建议用于严重肾功能不全患者。
参考来源:‘Acadia Pharmaceuticals Announces FDA Approval of DAYBUE® STIX (trofinetide) for Oral Solution, a New Powder Formulation of Trofinetide for the Treatment of Rett Syndrome’,新闻稿。Acadia Pharmaceuticals Inc.;2025年12月12日发布。
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指导,请咨询主治医师。