
胶质瘤占所有中枢神经系统肿瘤的四分之一以上。其治疗手段有限,死亡率与致残率居高不下,亟需发现具有变革潜力的治疗新靶点。癌症-睾丸抗原(CTAs)作为一类在多种肿瘤中异常表达的蛋白,参与调控肿瘤生长与凋亡抑制等多种致癌信号通路。在胶质瘤中,CTA的表达具有异质性,不仅是预后评估的标志物,更是极具潜力的治疗靶点。其中,含AAA结构域的ATP酶家族蛋白2(ATAD2)已在多种癌症的发生发展中发挥作用,然而其在胶质瘤中的调控机制尚不明确。
近期,海南医学院第一附属医院与同济大学医学院联合团队在Genes & Diseases期刊发表一项研究,深入揭示了ATAD2在胶质瘤恶性进展中的分子机制。
研究人员通过分析中国胶质瘤基因组图谱(CGGA)数据,基于CTA相关基因的表达特征将胶质瘤分为两个明显不同的亚型。进一步构建了名为CTARS的风险评分模型,该模型整合了10个CTA基因的表达与患者预后的关联,并被验证为独立的预后指标。结合年龄、肿瘤分级、1p/19q状态等临床变量,研究团队进一步开发出个体化预后列线图,可有效预测胶质瘤患者的临床结局。
生物信息学分析显示,ATAD2具有生物活性化合物结合能力及成药性结构。多个数据库均证实,其在胶质瘤组织中mRNA和蛋白水平均显著高表达,提示ATAD2与胶质瘤的临床及病理特征密切相关。
在LN229、U251MG、T98G等胶质瘤细胞系中的实验表明,ATAD2主要定位于细胞核内。敲低ATAD2可抑制肿瘤细胞增殖、生长与迁移,而过表达则产生相反效应。这一促癌作用在体内外实验中均得到验证,确认了ATAD2在胶质瘤恶性进展中的关键角色。
在机制层面,ATAD2与转录因子E2F1形成相互调控关系,并协同增强下游基因PDK1的转录活性。临床数据分析进一步显示,ATAD2、E2F1与PDK1三者均高表达的胶质瘤患者预后最差,提示“ATAD2–E2F1–PDK1”调控轴可作为潜在的临床预后生物标志物。
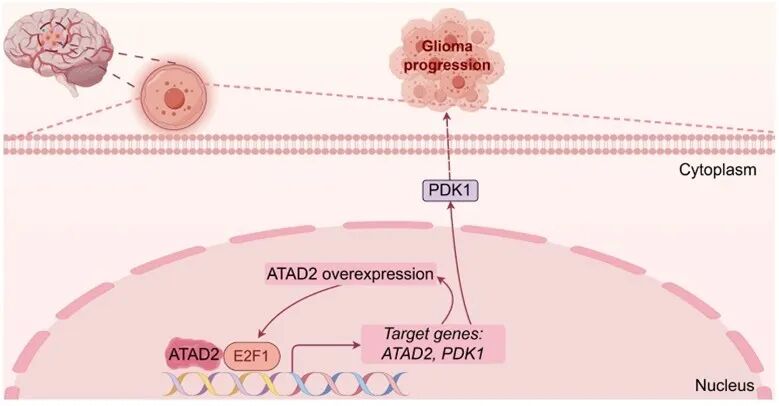
图1 ATAD2通过协同E2F1增强PDK1表达促进胶质瘤进展(原文中Figure 7F)
作者同时指出当前研究的若干局限性,包括:需扩大临床样本规模;补充ATAD2过表达在皮下及原位颅内荷瘤模型中的体内实验;进一步探索ATAD2的调控网络;验证ATAD2抑制剂与二氯乙酸盐联用的治疗效果;以及明确其在化疗耐药中的作用。
综上所述,本研究不仅确立了CTARS作为胶质瘤独立预后标志物的价值,更揭示了ATAD2通过与E2F1协同激活PDK1,从而驱动胶质瘤恶性进展的新机制(图1),为这一难治性肿瘤的靶向治疗提供了新的理论依据。